Определение железа (II) хроматометрическим методом основано на прямом титровании ионов железа (II) стандартным раствором бихромата в сернокислой или солянокислой среде в присутствии фосфорной кислоты:
6Fe2+ + Cr2O72- + 14Н+ ® 6FеЗ+ + 2Cr3+ + 7Н2О
Фосфорную кислоту прибавляют для того, чтобы связать в комплекс образующиеся ионы железа (III), что благоприятствует титрованию Fe(II);
6Fe3+ + 18НРО42- ® 6[Fe(HPO4)3]3-
Реактивы и оборудование. Титрант – стандартный раствор K2Cr2O7 с концентрацией С[1/6 K2Cr2O7] = 0,2 н.; коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; индикатор дифениламин; смесь кислот H2SO4 и H3PO4 1:1.
Выполнение работы.
1. Готовят раствор титранта, для чего пипеткой отбирают 25,00 см3 0,2 н. раствора бихромата калия и переносят в мерную колбу на 250,00 см3, доводят водой до метки и перемешивают. Бюретку для титрования и заполняют ее стандартным раствором K2Cr2O7.
2. Исследуемый раствор, содержащий ионы Fe2+ (выданный преподавателем) в мерной колбе 100,00 см3 доводят дистиллированной водой до метки.
3. Пипеткой отбирают 10,0 см3 раствора, переносят его в колбу для титрования, добавляют 50 мл дистиллированной воды.
4. Приливают 10 мл смеси кислот H2SO4 и H3PO4.
5. Добавляют 2 – 3 капли индикатора дифениламина.
6. Титруют полученную смесь стандартным раствором K2Cr2O7 до перехода окраски от зеленой к фиолетовой.
Запись данных опыта и расчеты. Данные записать по приведенной ниже форме.
Таблица. Определение содержания железа (II)
Определяемое вещество – Fe2+
Титрант – стандартный раствор K2Cr2O7 С[1/6 K2Cr2O7] = 0,02 н
Индикатор – дифениламин
Объем пробы – 100,00 см3
| № п/п | Объем Vа(Fe), см3 | Эквивалентный объем титранта V(K2Cr2O7), см3 |
| 10,0 | ||
По результатам титрования найти средний объем титранта 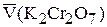 =
=
Рассчитать концентрацию Fe2+
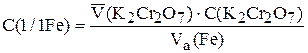 =
=
Рассчитать массу железа в пробе
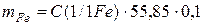 =
=
Контрольные вопросы
1. Окислительно-восстановительный потенциал и окислительно-восстановительная реакция.
2. Факторы, влияющие на величину окислительно-восстановительного потенциала. Константы равновесия окислительно-восстановительных реакций и их использование в анализе.
3. Построение кривой титрования.
4. Классификация методов окислительно-восстановительного титрования.
5. Индикаторы, используемые в окислительно-восстановительных методах титрования.
6. Характеристика метода, условия проведения определений, объекты анализа, достоинства и недостатки методов: перманганатометрия, иодометрия, хроматометрия, броматометрия, ванадатометрия, цериметрия и др.
 2015-01-30
2015-01-30 2505
2505
