Классификация липидов, как и других соединений биологической природы, — весьма спорный и проблематичный процесс. Предлагаемая ниже классификация, хоть и широко распространена в липидологии, является далеко не единственной. Она основывается, прежде всего, на структурных и биосинтетических особенностях разных групп липидов.
Простые липиды
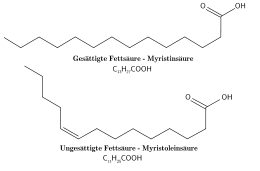
Примеры жирных кислот: миристиновая (насыщенная жирная кислота) и миристолеиновая (мононенасыщенная кислота) имеют 14 атомов углерода.
1. Жирные кислоты
2. Жирные альдегиды
3. Жирные спирты
4. Предельные углеводороды с длинной алифатической цепочкой
5. Сфингозиновые основания
Сложные липиды
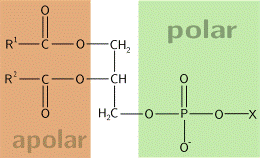
Общее строение фосфолипидов
Заместители R1 и R² — остатки жирных кислот, X зависит от типа фосфолипида.
1. Полярные
2. Фосфолипиды
3. Гликолипиды
4. Фосфогликолипиды
5. Сфинголипиды
6. Мышьяколипиды
7. Нейтральные
8. Ацилглицериды
9. Триглицериды (Жиры)
10. Диглицериды
11. Моноглицериды
12. Воски
13. Церамиды
14. Эфиры стеринов
15. N-ацетилэтаноламиды
Оксилипиды
1. Оксилипиды липоксигеназного пути
2. Оксилипиды циклооксигеназного пути
Структура. Наиб. распространенные типы липидов - глицеролипиды и производные сфингозина СН3(СН2)12СН=CHCH(OH)CH(NH2)CH2OH. В нейтральных глицеролипидах гидроксильные группы глицериназамещены остатками жирных кислот, алифатических спиртов или альдегидов. В полярных глицеролипидах двегидроксильные группы глицерина замещены чаще всего жирными кислотами, а третья связана либо с остатком ортофосфорной кислоты (свободной или этерифицированной холимом, этаноламином, серином, глицерином или миоинозитом), либо с остатками сахаров, как у гликозиллиглицеридов.
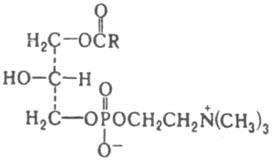
Положение заместителей в молекуле глицерина обозначают по т. наз. системе стереоспецифических нумераций: если в фишеровской проекции вторичная гидроксигруппа глицеринового остатка находится слева, то углеродным атомам, расположенным выше и ниже этой группы, присваивают соотв. номера 1 и 3, снабдив их индексом sn (напр., sn-1-ацил-3-глицерофосфохолин, см. формулу). Наряду с диацилглицерофосфолипидами распространены глицсрофосфолипиды, содержащие в положении sn-1-алкильные или 1-алкенильные заместители. В водных средах липиды образуют бислойные, гексагональные или мицеллярные структуры. В бислоях (см. Липидный бислой) насыщенные углеводородные цепи липидов, как правило, находятся в зигзагообразной конформации и расположены параллельно друг другу.
Ось sn-1-ацильной цепи совпадает с осью глицеринового остатка, тогда как sn-2-цепь на начальном СО—СН2-участке отходит от глицеринового остатка под прямым углом и, резко изгибаясь у альфа-углеродного атома, становится далее параллельной sn-1-цепи. Ненасыщенные углеводородные цепи липидов содержат одну или несколько этиленовых связей, которые, как правило, имеют цис-конфигурацию. При наличии двойных связей зигзагообразная конформация нарушается. В молекулах цвиттерионных фосфолипидов (например, фосфатидилхолина и фосфатидилэтаноламина) полярная группировка ("головка") расположена перпендикулярно осям ацильных цепей, а в молекулах отрицательно заряженных фосфолипидов (например, фосфатидилсерина) полярные головки направлены параллельно оси ацильных цепей. Уфосфосфинголипидов оси ацильных цепей и сфингозинового остатка также расположены параллельно друг другу. В случае сфингомиелина амидная группа, соединяющая эти остатки, расположена перпендикулярно к ним, а жирно-кислотная цепь изгибается у альфа-углеродного атома, подобно sn-2-цепи фосфоглицеридов. Иную пространственную структуру имеют гликосфинголипиды. У цереброзидов параллельное расположение алифатических цепей обеспечивается в результате изгибов цепи сфингозина при первом и шестом атомах С, а кольцо остатка моносахарида ориентировано почти перпендикулярно к углеводородным цепям. У гликосфинголипидов с олигосахаридной цепью последняя ориентирована преим. по направлению осей углеводородных цепей.
Получение липидов. Природные липиды выделяют из животных или микробных источников, комбинируя экстракцию органическими растворителями с хроматографическими методами очистки. При этом отдельные группы липидов получают в виде смеси однотипных веществ, имеющих одинаковые полярные головки, но различающихся по длине и степени ненасышенности алифатических цепей. Широко распространены полусинтетические методы - переацилирование природных липидов и превращение одних классов липидов в другие. В первом случае природные липиды, например фосфатидилхолины, подвергают деацилированию или ферментативному гидролизу с помощьюфосфолипазы А2, а затем полученный глицерофосфохолин
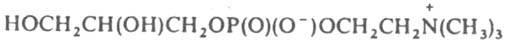
или лизофосфатидилхолин реацилируют индивидуальными жирными кислотами. При использовании для реацилирования синтетических кислот, несущих флуоресцентные, спиновые, фотореактивные группировки или радиоактивные метки, получают липидные зонды. Для превращения одних групп природных глицерофосфолипидов в другие используют реакцию трансфосфатидилирювания с помощью фосфолипазы D. Этим путем из фосфатидилхолина в присутвии воды, избытка этаноламина, серина или глицерина получают соответственно фосфатидовую кислоту, фосфатидилэтаноламин, фосфатидилсерин или фосфатидилглицерин. Фосфатидовая кислота, в свою очередь, может быть этерифицированахолином, этаноламином или серином в присутвии различных конденсирующих агентов. По другой схеме осуществляется неполный синтез сфинголипидов. Например, для превращения доступных сфингомиелинов в гликосфинголипиды исходный сфингомиелин гидролизуют в цсрамид CH3(CH2)12CH=CHCH(OH)CH[NH(О)CR']CH2OH, который превращают в 3-О-бензоильное производное. Последнее затем гликозилируют с помощью соответствующих бромзамещенных ацетилсахаров, после чего защитные бензоильную и ацетильные группы удаляют метанолизом в щелочной среде. Получение индивидуальных фосфолипидов и сфинголипидов обычно осуществляют полным хим. синтезом. Таким же путем получают также простагландины и другие эйкозаноиды.
Биосинтез глицеролипидов и сфинголипидов. Центральные промежуточные продукты биосинтеза глицеролипидов - 1,2-диглицериды и фосфатидовые кислоты. Последние образуются главным образом двумя путями: ацилированием sn-глицеро-3-фосфата с участием ацилкофермента А и ферментативным ацилированием дигидроксиацетонфосфата с последующим восстановлением его коферментом никотинамидадениндинуклеотидом (НАДН) с образованием лизофосфатидовой кислоты, которая далее ацилируется до фосфатидовой кислоты. Гидролиз последней под влиянием фосфатазы приводит к 1,2-диглицеридам, реагирующими с ацилкоферментом А с образованием триглицеридов или с АТФ с образованием фосфатидовой кислоты. Диглицериды вступают во взаимодействие с цитидинтрифосфатом, цитидиндифосфохолином или цитидиндифосфоэтаноламином, образуя соответственно фосфатидовую кислоту, фосфатидилхолин или фосфатидилэтаноламин, например:
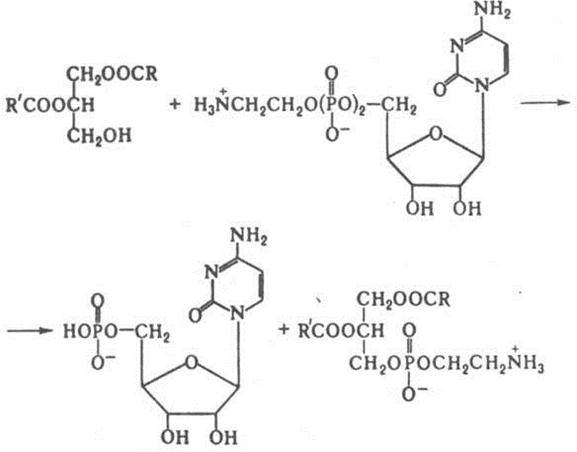
Фосфатидилэтаноламин, в свою очередь, может превращаться в фосфатидилхолин путем метилирования S-аденозилметионином или реагировать с серином, образуя в результате переэтерификациифосфатидилсерин. У бактерий осуществляется другой путь биосинтеза фосфатидилсерина ифосфатидилэтаноламина; фосфатидовая кислота, взаимодействуя с цитидинтрифосфатом, образует цитидиндифосфодиацилглицерин, который реагирует с серином, образуя фосфатидилсерин. Его декарбоксилирование приводит к фосфатидилэтаноламину, а реакция с глицерофосфатом – кфосфатидилглицерину. Последний вновь может взаимодействовать с цитидиндифосфодиацилглицерином, превращаясь в дифосфатидилглицерин. В биосинтезе сфинголипидов ключевое соединение - церамид, образующийся в результате N-ацилирования сфингозина ацилкоферментом А. Реакция церамида с цитидиндифосфохолином приводит к сфингомиелину, а его взаимодействие с производными уридина (уридиндифосфоглюкозой или уридиндифосфогалактозой) - к цереброзидам. Возможен и другой путь биосинтеза цереброзидов, основанный на реакции производных уридина со сфингозиновыми основаниями с образованием психозина (галактозид сфингозина) и его последующем N-ацилировании ацилкоферментами А. Из цереброзидов путем последоват. присоединения остатков моносахаридов и сиаловой кислоты под влиянием соответствующих гликозилтрансфераз образуются гликосфинголипиды с более длинными сахарными цепями.
Биологические функции липидов. В полной мере биолиологическая роль липидов еще не выяснена. Нейтральные липиды (жиры) представляют собой форму депонирования метаболической энергии. Фосфолипиды, гликолипиды и стерины - структурные компоненты мембран биологических; оказывают влияние на множество мембранных процессов, в т. ч. на транспорт ионов и метаболитов, активность мембраносвязанных ферментов, межклеточные взаимодействия и рецепцию. Некоторые гликолипиды -рецепторы или корецепторы гормонов, токсинов, вирусов и др. Фосфатидилинозиты участвуют в передаче биологических сигналов. Эйкозаноиды - высокоактивные внутриклеточные регуляторы, межклеточные медиаторы и иммуномодуляторы, участвующие в развитии защитных реакций и воспалительных процессов.
 2015-01-30
2015-01-30 2069
2069