Al2(SO4)3 NaHCO3 MgOHCl
сульфат алюминия гидрокарбонат натрия гидроксохлорид магния
 |
|
|
KAl(SO4)2 Ca(OCl)Cl K3[Fe(CN)6]
cульфат алюминия хлорид-гипохлорит гексацианоферрат (III)
калия кальция калия
Химические свойства средних солей:
1) с металлами (см. ряд напряжений): CuSO4 + Fe → FeSO4 + Cu;
2) с кислотами: Na2CO3 + 2 HCl → 2 NaCl + CO2 + H2O
3) с основаниями: CuSO4 + 2 KOH → Cu(OH)2↓ + K2SO4
4) с солями: AgNO3 + NaCl → AgCl↓ + NaNO3
Химические свойства кислых солей:
1) с сильными кислотами: Ca(HCO3)2 +2HCl → CaCl2 +2H2O + 2CO2
2) с сильными основаниями: Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Вывод: кислые соли проявляют амфотерные свойства
3) некоторые кислые соли подвергаются термическому разложению:
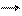 Ca(HCO3)2 t CaCO3 + CO2 + H2O
Ca(HCO3)2 t CaCO3 + CO2 + H2O
Химические свойства основных солей:
1) с сильными кислотами: CuOHCl + HCl → CuCl2 +H2O
2) с сильными основаниями: CuOHCl + NaOH → Cu(OH)2 + NaCl
Вывод: основные соли проявляют амфотерные свойства
3)  некоторые соли (летучих кислот) подвергаются термическому разложению: (CuOH)2CO3 t 2CuO + CO2 + H2O
некоторые соли (летучих кислот) подвергаются термическому разложению: (CuOH)2CO3 t 2CuO + CO2 + H2O
Чтобы среднюю соль перевести в кислую, нужно подействовать на нее той же самой кислотой, которой образована средняя соль:
 Na2SO4 + H2SO4 2NaHSO4
Na2SO4 + H2SO4 2NaHSO4
 CaCO3 + CO2 + H2O Ca(HCO3)2
CaCO3 + CO2 + H2O Ca(HCO3)2
Чтобы среднюю соль перевести в основную, нужно подействовать на нее недостатком щелочи:
 Fe Cl2 + NaOH FeOHCl + NaCl
Fe Cl2 + NaOH FeOHCl + NaCl
 2015-01-07
2015-01-07 1173
1173








