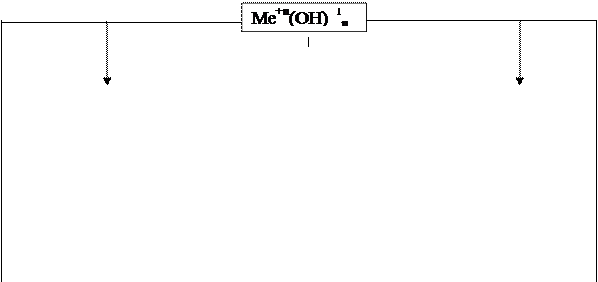 |
1. По числу гидроксильных групп (ОН−1):
 | ||||||
|
|
KOH Ba(OH)2 Fe(OH)3
2. По степени растворимости в воде:
 |  |
NaOH Ca(OH)2
3. По степени диссоциации (α):
 |  |
 Необходимо запомнить сильные основания – это основания, образованные щелочными и щелочноземельными металлами (кроме Be и Mg).
Необходимо запомнить сильные основания – это основания, образованные щелочными и щелочноземельными металлами (кроме Be и Mg).
Таблица 2 - Классификация оснований по степени диссоциации
| Сильные основания | Слабые основания | ||
| Формула | Название | Формула | Название |
| LiOH | Гидроксид лития | NH4OH или NH3 ∙ H2O | гидроксид аммония |
| NaOH | Гидроксид натрия | Fe(OH)3 | гидроксид железа (III) |
| KOH | Гидроксид калия | все остальные | |
| RbOH | Гидроксид рубидия | ||
| CsOH | Гидроксид цезия | ||
| FrOH | Гидроксид франция | ||
| Ca(OH)2 | Гидроксид кальция | ||
| Sr(OH)2 | Гидроксид стронция | ||
| Ba(OH)2 | Гидроксид бария |
Химические свойства оснований:
1) с кислотами: 2 KOH + H2SO4 → K2SO4 + 2 H2O;
2) с кислотными оксидами: 2 KOH + CO2 → K2CO3 + H2O;
3) с солями (р): 2 KOH + CuSO4 → Cu(OH)2↓ + K2SO4;
4) нерастворимые основания разлагаются при нагревании:
 Cu(OH)2 t CuO + H2O;
Cu(OH)2 t CuO + H2O;
5) амфотерные гидроксиды взаимодействуют как с кислотами, так и с основаниями: Al(OH)3 + 3 HCl → AlCl3 + 3 H2O;
Al(OH)3 + NaOH → Na[Al(OH)4]
4. 

 Соли
Соли
Cредние соли: ● соединения, состоящие из атомов металла и кислотных
остатков.
● электролиты, которые при растворении в воде диссоциируют на катионы металла и анионы кислотных остатков.

 2015-01-07
2015-01-07 1355
1355
