При равновесии гетерогенной системы на поверхности фаз наблюдаются изменения концентраций компонент системы по сравнению с их значениями в объеме фазы.
Концентрация одного из компонентов на поверхности раздела двух фаз называется адсорбцией. Она может происходить из газов, жидкостей или путем адсорбирования растворенного вещества из раствора. Адсорбируемое вещество может концентрироваться на поверхности раздела твердое тело - газ, твердое тело - жидкость, жидкость - жидкость и жидкость - газ. Тело, не поверхности которого адсорбируются молекулы другого вещества, называются адсорбентом, а концентрирующееся на границе раздела - адсорбатом. Явление, при котором вещество не только не накапливается на поверхности, но, наоборот, переходит с поверхностного слоя в объем, называют отрицательной адсорбцией.
Поверхностное натяжение жидкости зависит не только от температуры и других параметров состояния, но и от наличия в ней растворимых примесей. Так, например, поверхностное натяжение воды σ существенно понижается при растворении в ней спиртов, жирных, кислот, их солей и других поверхностно-активных веществ. Объясняется это тем, что при наличии ПАВ минимальное значение свободной энергии F =σSn , поверхностного слоя достигается за счёт уменьшения σ, поскольку Sn сохраняется при этом постоянной. Чтобы это условие выполнялось ПАВ не должно равномерно распределяться по всему объему раствора, а концентрироваться на его поверхности, обеспечивая тем самым понижение σ. Если же растворенное вещество способно увеличивать поверхностное натяжение, то система, стремясь уменьшить поверхностную энергию, заставит его уйти внутрь жидкости, обеспечивая тем самым минимальное увеличение σ.
Адсорбционные явления широко используют на практике, в частности для уменьшения испарения воды с поверхности водоёмов в засушливых районах, при флотации и др.
Особо следует отметить роль адсорбции в загрязнении вод Мирового океана. ПАВ, адсорбирующиеся на поверхности воды, служат центром концентрации органических веществ -главного источника питания нужных морских организмов. Органические загрязнения и, прежде всего нефть и продукты её переработки являются также ПАВ, Адсорбируясь на мельчайших частицах планктона и нейстона, они резко снижает их пищевую ценность для множества приповерхностных обитателей моря. Борьба за чистоту поверхности морен и океанов должна вестись с учетом этих и других адсорбционных процессов.
Адсорбционное равновесие определяется конкуренцией двух процессов: молекулярным притяжением, стремящимся концентрировать частицы определенного сорта на поверхности, и тепловым движением, стремящимся равномерно распределить их по всему объему. Количественно адсорбция характеризуется массой или числом молей адсорбата, находящихся на единице поверхности раздела фаз. Обозначается через 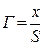 . Единицы измерения адсорбции моль/см2, г/см2 и др. В других случаях адсорбцию характеризуют количеством адсорбата на единицу массы адсорбента. Обозначается через
. Единицы измерения адсорбции моль/см2, г/см2 и др. В других случаях адсорбцию характеризуют количеством адсорбата на единицу массы адсорбента. Обозначается через 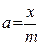 . Процессы в приповерхностном слое, происходящие при неизменной температуре описываются свободной энергией F. Для данной массы раствора свободная энергия зависит от величины поверхности и объема (или концентрации), т.е. FT = F(V,S).
. Процессы в приповерхностном слое, происходящие при неизменной температуре описываются свободной энергией F. Для данной массы раствора свободная энергия зависит от величины поверхности и объема (или концентрации), т.е. FT = F(V,S).
Изотермическая работа изменения состояния раствора зависит от изменения поверхности и концентрации:
dAT = -σ dS + pdV (I)
Эта работа равна убыли свободной энергий системы, то есть:
dAT = -dFT (2)
Дифференциал свободной энергии:
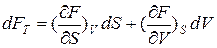 (3)
(3)
Сравним (I) и (3) и, учитывая (2), получим:
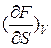 = σ,
= σ, 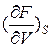 = -P (4)
= -P (4)
Дифференцируя (4) по перекрестным переменным, находим:
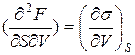 ,
, 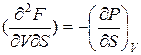
Поскольку при этом 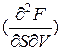 =
= 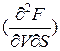 , то и
, то и
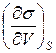 = -
= - 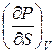 (5)
(5)
В растворе при равновесном состоянии часть растворенного вещества находится в объеме V, а часть адсорбирована на поверхности S. Поэтому массу растворенного вещества можно представить как сумму
m = сV + rS. (6)
Из (6) можно определить концентрацию раствора:
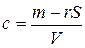 (7)
(7)
При отсутствии адсорбции (Г = 0) концентрация 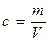 . Если происходит адсорбция, то концентрация зависит от V и от S. Выведем уравнение Гиббса для адсорбции Г, то есть найдем связь между величиной адсорбции и поверхностным натяжением.
. Если происходит адсорбция, то концентрация зависит от V и от S. Выведем уравнение Гиббса для адсорбции Г, то есть найдем связь между величиной адсорбции и поверхностным натяжением.
Входящие в (5) производные можно представить в виде:
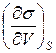 =
= 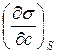
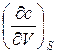 и
и 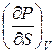 =
= 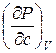
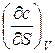 (8)
(8)
Из (7) следует, что 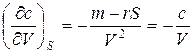
 ,
, 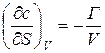

Используя эти выражения уравнение (5) можно записать в виде
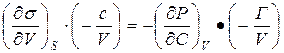 .
.
Откуда, после сокращений, получим
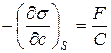
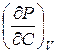
Поскольку для единицы массы раствора давлениеравно Р =СRT, то 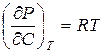 , и, следовательно
, и, следовательно 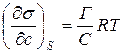 ,
,
Откуда 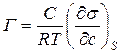 (9)
(9)
Это выражение представляет собой так называемуюформулу Гиббса.Она дает возможность рассчитать избыток вещества в поверхностном слое.
Поскольку в состоянии равновесия свободная энергия минимальна, то в поверхностном слое должны скапливаться вещества, понижающие поверхностное натяжение, то есть такие, для которых 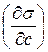 < 0. В соответствии с (9) в этом случае Г>0 и адсорбция будет положительной. Такие вещества называются поверхностно - активными (ПАВ).
< 0. В соответствии с (9) в этом случае Г>0 и адсорбция будет положительной. Такие вещества называются поверхностно - активными (ПАВ).
Если же вещества понижают поверхностное натяжение, то уменьшение свободной энергии повepxнoстного слоя будет происходить при уходе этих молекул из поверхностного слоя внутрь жидкости. В этом случае в соответствии с (9) Г<0, тоесть имеет место отрицательная адсорбция. Такие вещества называются поверхностно-инактивными.
Величину 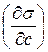 , определяющую меру изменения поверхностного натяжения с изменением концентрации, называют активностью.
, определяющую меру изменения поверхностного натяжения с изменением концентрации, называют активностью.
|
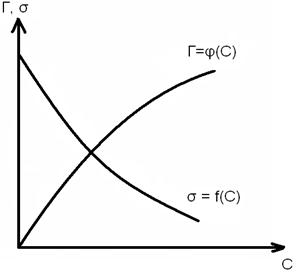
 Формула Гиббса позволяет рассчитать адсорбцию по зависимости поверхностного натяжения от концентрации раствора. Если эту зависимость определить экспериментально при постоянной температуре, то есть получить изотерму поверхностного натяжения в виде кривой σ = f (С), То по формуле Гиббса можно построить изотерму адсорбции Г = φ (C),
Формула Гиббса позволяет рассчитать адсорбцию по зависимости поверхностного натяжения от концентрации раствора. Если эту зависимость определить экспериментально при постоянной температуре, то есть получить изотерму поверхностного натяжения в виде кривой σ = f (С), То по формуле Гиббса можно построить изотерму адсорбции Г = φ (C), Для описания адсорбции ПАВ используется также уравнение изотермы 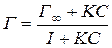 , (10)
, (10)
 предложенное Лэнгмюром для адсорбции на твёрдых телах. В этом уравнении:
предложенное Лэнгмюром для адсорбции на твёрдых телах. В этом уравнении: 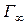 - предельная адсорбция, когда молекулы адсорбатаполностью покрывают поверхность жидкости, К – экспериментально определяемый параметр.
- предельная адсорбция, когда молекулы адсорбатаполностью покрывают поверхность жидкости, К – экспериментально определяемый параметр.
|
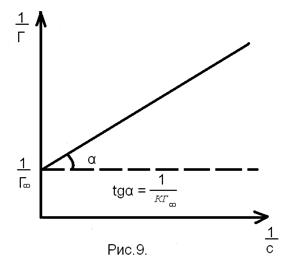
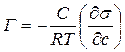 необходимо найти производную
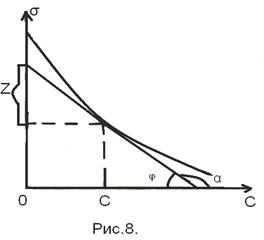
необходимо найти производную 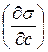 . Это выполняется графически. В различных точках кривой σ= f (c) проводятся касательные до пересечения с осью ординат и прямые, параллельные оси абсцисс. Как видно из рисунка
. Это выполняется графически. В различных точках кривой σ= f (c) проводятся касательные до пересечения с осью ординат и прямые, параллельные оси абсцисс. Как видно из рисунка 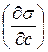 = tgα = tg (180-φ)= =-tgφ=
= tgα = tg (180-φ)= =-tgφ= 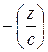 . После подстановки в уравнение Гиббса, получим:
. После подстановки в уравнение Гиббса, получим: 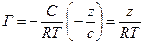 ,
, 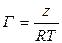 (11)
(11) Проводя касательные в различных точках кривой σ= f (с), можно вычислить зависимость адсорбции Г от концентрации Г= Г(С). По полученной таким образом Г =Г(С)можно рассчитать параметры уравнения Лэнгмюра и определить размеры адсорбируемых молекул. Для этого перепишем уравнение Лэнгмюра в следующем виде:
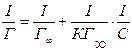 (12)
(12)
|
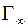 , легко рассчитать площадь, занимаемую одной молекулой. Действительно, если
, легко рассчитать площадь, занимаемую одной молекулой. Действительно, если 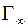 в уравнении Лэнгмюра представляет собой предельную адсорбцию, выраженную в моль/см2, то число молекул адсорбированных на единице площади поверхности (см2), равно
в уравнении Лэнгмюра представляет собой предельную адсорбцию, выраженную в моль/см2, то число молекул адсорбированных на единице площади поверхности (см2), равно 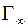 NA, так как в одном моле содержится NA молекул. Величина обратная этому числу, является площадью поверхностного слоя, занимаемой одной молекулой адсорбированного вещества.
NA, так как в одном моле содержится NA молекул. Величина обратная этому числу, является площадью поверхностного слоя, занимаемой одной молекулой адсорбированного вещества. 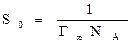 (13)
(13)
Зная S 0, можно приближенно вычислить толщину поверхностного слоя, то есть осевую длину ориентированной молекулы. Действительно, объем соответствующий 1см2площади поверхностного слоя, численно равен толщине слоя в сантиметрах (δ) адсорбируемого вещества ρ, молекулярный вес μ, то ρδ= 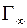 μ, и, следовательно,
μ, и, следовательно,
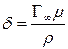 . (14)
. (14)
Для органических кислот с общей формулой Сn Н2n+1OOН и спиртов с общей формулой Сn Н2n+1ОНплощадьS о равна примерно 21 10-10см2.
При увеличении числа полярных групп в молекуле, соответственно увеличивается и δ. Исследования толщины мономолекулярного слоя показали, что удлинение углеводородной цепи на одну группу вызывает увеличение δ в среднем на 1,4 10-8см. Определение поперечного сечения и длины молекул позволило впервые установить размеры и форму различных молекул. Вместе с исследованием поверхностных пленок растворимых веществ этот метод в настоящее время имеет большое значение как для теории строения, так и, для определения структуры ориентированных слоев.
Целью настоящей работы является экспериментальное получение изотерм поверхностного натяжения и адсорбции ПАВ из водных растворов, а также вычисление поперечного сечения и осевой длины молекулы ПАВ.
1. В мерных колбах готовят водные растворы спирта с концентрацией 0,4, 0,3, 0,2, 0,1, 0,05 моль/л.
2. Определяется поверхностное натяжение водных растворов спирта, начиная с самых низких концентраций. Поверхностное натяжение определяется по методу наибольшего давления в пузырьке вприборе Ребиндера при температуре, указанной преподавателем (температура может быть задана в пределах от 15° до 45°С). Перед началом опытов вся мерная посуда и прибор Ребиндера должны быть тщательно промыты хромовой смесью и многократно дистиллированной водой. Давление воздуха в системе регулируют таким образом, чтобы пузырьки проскакивали с интервалом в 10 - 20 секунд, каждое измерение повторяют не менее трех - пяти рази берут среднее значение, температура опыта должна поддерживатьсяпостоянной
в течение всей серии измерений с точностью + 0,1°.
3. Пользуясь табличными данными по поверхностному натяжению чистой воды, рассчитывают поверхностное натяжение растворов и строят в крупном масштабе график зависимости σ= f( с),
4. Пользуясь опытной кривой σ = f (с), с помощью уравнения Гиббса графически рассчитывают изотерму адсорбции Г= f (с) и тоже наносят на график.
5.Из уравнения Лэнгмюра (12) рассчитывают значение предельной адсорбции Г, а затем по формулам (13) и (14) вычисляют площадь, занимаемую одной молекулой (S0) и ее осевую длину.
6.Результаты опыта и расчетные данные заносят в таблицу.
| № | С, 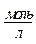 | h | 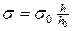  | Z |  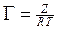 | 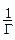 |  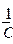 | 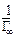 | 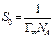 | 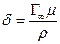 |
 2015-01-07
2015-01-07 4060
4060
