Цель работы: определение водородного показателя среды индикаторами.
Вода, хотя и весьма незначительно, но, все же, диссоциирует на ионы. При электрической диссоциации воды образуется равное количество ионов Н+ и ОН-
Н2О 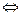 Н+ + ОН-
Н+ + ОН-
Произведение концентрации водородных и гидроксильных ионов называется ионным произведением воды.
КВ = [Н+] [OH-].
Константа диссоциации воды
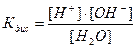
Константа диссоциации воды при 295 К равна 18∙10-16. Ввиду весьма малой степени диссоциации, равновесная концентрация воды практически равна числу молей воды в 1 л, а именно: 1000/18 = 55,56 моль/л, т.е. является постоянной величиной. Отсюда КВ = [Н+] [OH-] = 1,8∙10-16 ∙ 55,56 = 10-14.
В любых водных растворах имеются гидроксильные и водородные ионы, но в таких концентрациях, что их концентрация равняется 10-14.
Среда водного раствора электролита может быть кислой, нейтральной или щелочной. Носителями кислотных свойств являются ионы Н+, а основных – ионы ОН-, поэтому в кислых растворах [H+] > [OH-], а в щелочных - [H+] < [OH-]. Растворы, в которых [H+] = [OH-] называют нейтральными. В нейтральных растворах [H+] = 10-7 моль/л.
Концентрация водородных ионов удобно выражать с помощью водородного показателя рН.
Водородным показателем (рН) называется отрицательный десятичный логарифм концентрации гидроксильных ионов. Отрицательный десятичный логарифм концентрации гидроксильных ионов называется показателем концентрации гидроксильных ионов:
рН = - lg[H+], pOH = - lg[OH-],
lg[H+] + lg[OH-] = -14.
Взяв отрицательные логарифмы, получим соотношение
рН + рОН = 14.
В нейтральной среде рН = 7, в щелочной рН > 7, в кислой рН < 7.
Ниже приведена шкала кислотности и щелочности среды:
 нейтральная
нейтральная















 рН
рН
1 2 3 4 5 6 7 8 9 10 11 12 13 14

 кислая среда щелочная среда
кислая среда щелочная среда
Для приблизительного определения рН используют так называемые кислотно-щелочные индикаторы – т.е. вещества, которые меняют свою окраску в зависимости от щелочности или кислотности среды. Часто с этой целью употребляют лакмус, фенолфталеин или метилоранж.
Изменение окраски различных индикаторов происходит при вполне определенных для каждого из них значениях рН. Например, окраска метилоранжа от красной до желтой меняется в интервале от 3,1 до 4,4. Промежуток между двумя значениями рН, в котором изменяется окраска индикатора, называется интервалом индикатора. В таблице ниже приведены интервалы некоторых индикаторов.
| Название индикатора | Цвет при значениях рН ниже интервала индикатора | Интервал индикатора | Цвет при значениях рН выше интервала индикатора |
| Метилоранж | Красный | 3,1 – 4,4 | Желтый |
| Лакмус | Красный | 5,0 – 8,0 | Синий |
| Фенолфталеин | Бесцветный | 8,3 – 10,5 | Малиновый |
Наряду с одноцветными и двухцветными индикаторами в практике химических реакций широко используют универсальный индикатор, применение которого дает возможность определить кислотность среды в широких интервалах значений рН. Цвет универсального индикатора изменяется от всех оттенков: красного (кислая среда) до темно-фиолетового (щелочная среда), желтая окраска (нейтральная среда). Универсальный индикатор применяется или в виде раствора, или в виде индикаторной бумаги. К папке индикаторной бумаги прилагается цветная шкала, показывающая, какую окраску принимает бумага, при различных величинах рН.
Практически рН определяется так: на полоску индикаторной бумаги наносят каплю исследуемого раствора. Полученную окраску индикаторной бумаги сравнивают с окраской шкалы и по шкале определяют рН с точностью до единицы.
Для более точного определения рН пользуются электрохимическим методом. Он основан на изменении разности потенциалов двух электродов, помещенных в анализируемый раствор. Один из этих электродов – электрод сравнения – в процессе изменения имеет постоянный потенциал, а потенциал второго электрода (обычно стеклянного) зависит от величины Н+ в анализируемом растворе. Электрохимический метод определения водородного показателя называют еще методом рН-метрии.
Пример 1. Вычислите рН 0,01 М раствора HNO3.
Решение: рН = – lg[H+].
[H+] = 0,01моль/л
рН = – lg 0,01 или рН = – lg 10-2
рН = 2.
При расчете рН раствора щелочи целесообразно воспользоваться приведенной схемой для вычисления гидроксильного показателя среды рОН, а затем найти водородный показатель среды по разности
рН = 14 – рОН.
Водородный показатель растворов слабых кислот и оснований наиболее просто вычисляются из концентраций раствора и константы диссоциации растворенного электролита.
Концентрацию продиссоциировавших на ионы молекул электролита определяют исходя из степени диссоциации
С = α∙С0,
где С0 – исходная концентрация молекул, моль/л.
Степень диссоциации рассчитывают на основании закона Оствальда
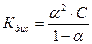
Чаще пользуются формулой КД = α2 ∙С, считая что α << 1.
Константу диссоциации находят по таблице.
Пример 2. Вычислите рН 0,01 М раствора NH4OH.
Решение: Степень диссоциации NH4OH в 0,01 М растворе равна:
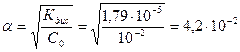
Находим концентрацию молекул NH4OH, распавшихся на ионы, и равную ей концентрацию ионов ОН-:
С = α ∙С0 = 4,2 ∙ 10-2 ∙ 10-2 = 4,2 ∙ 10-4 моль/л,
[OH-] = 4,2 ∙ 10-4 моль/л.
Определяем рОН и рН 0,01 М раствора NH4OH:
рОН = – lgOH- = – lg 4,2 ∙ 10-4 = 3,33
рН = 14 – 3,33 = 10,67.
 2015-01-07
2015-01-07 4116
4116
