Опыт 1. Определение молекулярной массы глюкозы.
Опыт проводят в приборе, показанном на рис. 4. Он состоит из пробирки 1 с боковым отростком 2. Пробирка закрыта резиновой пробкой 3 с двумя отверстиями, в одно отверстие вставлен термометр 4, в другое – мешалка 5.
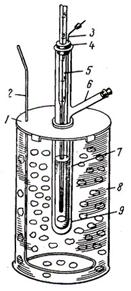
Рисунок 4. Термостат
Пробирку с термометром и мешалкой вставляют в широкую пробирку 6, которая служит воздушным холодильником и обеспечивает равномерное охлаждение раствора в пробирке. Широкую пробирку вставляют в отверстие металлической крышки 7, которую надевают на толстостенный стеклянный сосуд 8 с охладительной смесью. В другое отверстие крышки 7 вставляют мешалку 9 для перемешивания охладительной смеси.
Работу проводите в следующем порядке:
1. Соберите прибор (рис. 4).
2. Приготовьте охладительную смесь из 3 частей снега или толченного льда и 1 части поваренной соли. Поместите смесь в сосуд 8, измерьте обычным термометром температуру охладительной смеси. Она должна быть в пределах от –3 до –5 0С, что достигается изменением соотношения снега (льда) и соли.
3. Отмерьте пипеткой и налейте во внутреннюю пробирку точно 10 мл дистиллированной воды, погрузите в нее термометр (с делениями до 0,1 0С), настолько, чтобы шарик с ртутью был закрыт жидкостью.
4. Поместите внутреннюю пробирку, предварительно охлажденную в смеси воды со льдом, во внешнюю пробирку и погрузите последнюю и сосуд с охлажденной смесью.
5. Наблюдайте понижение столбика ртути термометра. Когда температура достигнет, примерно, –1 0С (достигнуто переохлаждение), начните энергично перемешивать воду мешалкой. При этом выпадут кристаллы льда, а столбик ртути станет быстро подниматься вверх. Отмерьте температуру, до которой поднимается столбик ртути. Это и будет температура замерзания чистого растворителя.
6. Нагрейте внутренний сосуд рукой и ещё раз определите температуру замерзания воды (растворителя). Из-за недостаточности показаний термометра точка замерзания может не совпадать с нулём шкалы.
7. Навеску глюкозы (0,4 г) высыпать в воду внутренней пробирки (остатки со стеклышка смести кисточкой).
8. По п.5 определить температуру замерзания полученного раствора. Под температурой замерзания раствора следует понимать температуру начала замерзания, ибо процесс замерзания раствора (в отличие от растворителя) идет при постепенно снижающейся температуре.
9. Нагрейте пробирку рукой и повторите определение температуры замерзания раствора глюкозы.
10. По полученным данным вычислите молекулярную массу глюкозы.
Оформление отчета.
1. Масса растворителя, г.
2. Температура замерзания растворителя t0.
I
II
средняя
3. Навеска вещества, г.
4. Температура замерзания раствора t.
I
II
средняя
5. Δ tоп =
6. Δt теор =
7. Число ионов n, образующихся при диссоциации одной молекулы.
8. Молекулярная масса глюкозы по эксперименту.
Сравнить вычисленную молекулярную массу с теоретической. Вычислить относительную ошибку по формуле
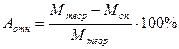
Опыт 2. Определение кажущейся степени электролитической диссоциации.
Взвесьте 0,12 г поваренной соли (работа проводится в приборе, описанном в опыте 1), перенесите во внутреннюю пробирку, добавьте 10 мл дистиллированной воды. Размешайте содержимое пробирки до тех пор, пока вся соль не растворится. Погрузите в нее термометр и определите температуру замерзания. По полученным данным вычислите изотонический коэффициент (i) и степень электролитической диссоциации (α).
 2015-01-07
2015-01-07 675
675








