Опыт 1. Определить характер гидролиза.
Налить в пробирки по 2 - 3 мл растворов хлорида натрия, карбоната натрия, хлорида цинка, сульфата аммония. С помощью растворов индикаторов определить реакцию среды. Объяснить результаты и написать уравнения соответствующих реакций в молекулярной и ионной формах.
Опыт 2. Сравнение степеней гидролиза различных солей.
В две пробирки налить по 2 - 3 мл 0,05 М растворов карбоната натрия и сульфата натрия. Прибавить по 2 - 3 капли растворов индикатора (какого?). Какая соль гидролизуется больше? Пользуясь величинами соответствующих констант диссоциации кислот, вычислить степень гидролиза и рН растворов: КH 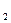 CO
CO 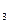 = 4,5∙10-7, КH
= 4,5∙10-7, КH 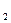 SO
SO 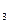 = 1,7∙10-2. Составить уравнения гидролиза.
= 1,7∙10-2. Составить уравнения гидролиза.
Опыт 3. Необратимый гидролиз.
К 1 - 2 мл раствора сульфата алюминия добавить такой же объем раствора соды. Какой осадок образуется? Написать уравнение гидролиза в молекулярном и ионном виде.
Опыт 4. Влияние разбавления на гидролиз.
К 1 - 2 мл раствора нитрата висмута прибавить по каплям небольшой объем воды до появления мути. Что происходит? Написать уравнение реакции. Каким способом можно сдвинуть равновесие в сторону уменьшения гидролиза?
Опыт 5. Влияние температуры на гидролиз.
Налить в пробирки по 3 мл 1 н. раствора ацетата натрия, хлорида аммония, сульфата алюминия. Прибавить по 3 - 4 капли универсального индикатора и растворы нагреть почти до кипения. Как изменится цвет индикатора и рН растворов. Написать уравнения реакций гидролиза и объяснить изменение реакции среды при нагревании.
Опыт 6. Растворение веществ в продуктах гидролиза.
Налить в пробирку 3 - 4 мл раствора хлорида цинка. Определить реакцию среды с помощью индикатора. В раствор опустить кусочек цинка и нагреть. Какой газ выделяется? Какова роль нагревания? Написать уравнения реакций.
Форма отчета.
1. Название и цель работы.
2. Уравнения реакций (в молекулярной и ионной формах) для каждого опыта и вывод из него.
Вопросы и задачи.
1. Что такое гидролиз? Какие из перечисленных солей будут подвергаться гидролизу: K2CO3, KCl, Li2SO4, Hg(NO3)2, MgCl2, Cr2(SO4)3, Zn(CH3COO)2, FeSO4? Указать реакцию среды водных растворов этих солей и написать уравнения реакций гидролиза в молекулярной и ионно-молекулярной формах.
2. Как изменится степень гидролиза при разбавлении, при нагревании? Почему?
3. Можно ли в растворах солей, подвергающихся гидролизу, предотвратить гидролиз? Как это сделать?
4. В растворах каких солей (растворы равной концентрации) степень гидролиза будет больше: Be(NO3)2 или Zn(NO3)2? NaCN или NaNO2?
5. Написать ионные и молекулярные уравнения гидролиза сульфата железа (III) и сульфида натрия. Как можно усилить гидролиз этих солей и как ослабить его?
6. При действии на раствор соли Fe3+ карбонатом натрия в осадок выпадает не карбонат железа, а его гидроксид. Как это объяснить?
7. Как сместится равновесие гидролиза следующих солей: ZnSO4, KSbO2, KNO2, AlOHSO4 при добавлении к раствору HCl, KOH, NH4Cl?
Работа № 10
 2015-01-07
2015-01-07 1408
1408
