Цель работы: ознакомление с методами получения коллоидных растворов и их свойствами.
Системы, в которых одно вещество распределено в мелко раздробленном состоянии в среде другого, называются дисперсными.
Вещество, распределенное в виде отдельных твердых частиц, капелек жидкости или пузырьков газа, составляет дисперсную фазу, а вещество, окружающее частички дисперсной фазы, называется дисперсной средой.
Например, в мутной воде, содержащей глину, дисперсной фазой являются частички глины, а дисперсной средой – вода; в тумане дисперсная фаза – частички жидкости, дисперсная среда – воздух; в дыме дисперсная фаза – твердые частички, а дисперсная среда – воздух и т.д.
К дисперсным системам относятся обычные (истинные) растворы, коллоидные растворы, а также суспензии и эмульсии. Все они отличаются друг от друга размером частиц, т.е. степенью дисперсности.
Коллоидными называются растворы, в которых линейные размеры частиц дисперсной фазы лежат в пределах от 1 до 100 нм.
Коллоидная дисперсность вещества является промежуточной между грубой дисперсностью, характерной для взвесей (суспензий, эмульсий), и молекулярной, характерной для истинных растворов. Поэтому коллоидные растворы получают либо из истинных растворов путем укрупнения частиц молекулярной дисперсности до определенного предела (максимум до 100 нм), либо взвесей путем дробления грубодисперсных частиц также до определенного предела (минимум до 1 нм). В этой связи различают конденсационные методы (укрупнение частиц) и методы диспергирования (дробление частиц).
Коллоидные растворы (или золи) относятся к числу гетерогенных дисперсных систем, характеризующихся высокой степенью раздробленности дисперсной фазы.
Золи обладают рядом специфических свойств, которые подробно изучает коллоидная химия. Так, золи в зависимости от размеров частиц могут иметь различную окраску, а у истинных растворов она одинаковая. Например, золи золота могут быть синими, фиолетовыми, вишневыми, рубиново-красными.
В отличие от истинных растворов, для коллоидных растворов характерно явления Тиндаля. Оно заключается в том, что при пропускании через золь пучка света в результате светорассеяния его коллоидными частицами появляется светлый конус, видимый в темном помещении.
Коллоидные частицы имеют сложное строение. Они состоят из ядер, а также адсорбированных и притянутых ионов. В качестве примера рассмотрим строение коллоидной частицы кремниевой кислоты. Ядро частицы нейтрально, оно состоит из молекул (m) кислоты. На поверхности ядра адсорбируются n ионов SiO32- (так как золь получается прибавлением к соляной кислоте раствора Na2SiO3). Как правило, адсорбируются ионы, близкие по своей природе к составу ядра (в примере SiO32-). Это потенциалопределяющие ионы, т.к. они обуславливают заряд частиц золя.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака – противоионы (в примере ионы Н+), причем часть их 2(n – х) адсорбируется на частице.
Адсорбированные SiO32- вместе с адсорбированными противоионами Н+ образуют адсорбционный слой. Другая часть противоионов 2х Н+ находится в жидкой фазе и образует подвижный диффузный слой.
Ядро вместе с адсорбированным слоем называется гранулой. В примере гранула заряжена отрицательно, поскольку адсорбция ионов SiO32- происходит сильнее, чем ионов Н+.
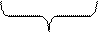
Гранула вместе с противоионами диффузного слоя называется мицеллой. Строение мицеллы кремниевой кислоты можно представить следующей схемой:
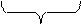
 {[H2SiO3] m ∙ n SiO32- ∙ 2(n – x) H+}- ∙ 2x H+
{[H2SiO3] m ∙ n SiO32- ∙ 2(n – x) H+}- ∙ 2x H+
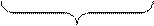
Ядро потенциалопре- противоионы
деляющие ионы
 |
 адсорбционный слой диффузный слой
адсорбционный слой диффузный слой
гранула
Здесь m – число молекул в ядре,
n – число ионов, адсорбированных на ядре,
2(n – x) – число противоионов адсорбированного слоя,
2х – число противоионов диффузного слоя.
Из схемы видно, что мицелла электронейтральна, гранула несет электрический заряд (в примере отрицательный).
Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести называется седиментацией. Процесс, обратный коагуляции, называется пептизацией.
Чаще всего золи коагулируют прибавлением электролита. В этом случае происходит нейтрализация зарядов коллоидных частиц ионами электролита.
Значение золя значительно велико, так как они распространены больше, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений – все это сложные золи. С золями связано получение искусственных волокон, дубление кож, крашение, изготовление клеев, лаков, пленок, чернил. Много золей в почве, и они имеют первостепенное значение для ее плодородия.
 2015-01-07
2015-01-07 909
909








