Флавоноидами называется группа природных кислородсодержащих гетероциклических соединений, производных бензо-g-пирона. Они являются одной из самых распространенных групп фенольных соединений растительного происхождения, объединенных общим структурным составом С6-С3-С6 (дифенилпропан).
В зависимости от степени окисленности g-пиранового цикла большинство флавоноидов можно рассматривать как производные хромона или хромана, содержащие в положении 2, 3 или 4 арильный радикал:
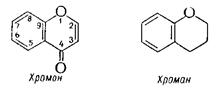
Свое название они получили от латинского слова “flavus” - желтый, поскольку первые выделенные из растений флавоноиды имели желтую окраску.
Основные исследования по выяснению химической природы флавоноидов и их синтезу были проведены на рубеже XIX и XX веков А.Г. Перкиным, С. Костанецким, Р. Робинсоном и др. Начало отечественным работам по изучению флавоноидов растений положено в 1863 г. русским ботаником А.П. Бородиным. В первые годы XX столетия Н.А. Валяшко определил строение ряда флавоноидов, в частности, им была установлена структура такого широко известного в настоящее время флавоноида, как рутин.
Распространение в растительном мире и роль флавоноидов в растениях. Флавоноидные соединения в большем или меньшем количестве содержатся почти во всех растениях; их встречаемость в высших растениях достигает 80%. Флавоноиды присущи в основном высшим растениям, однако встречаются также в водорослях, грибах и мхах. Наиболее богаты флавоноидами растения семейств Fabaceae, Rutaceae, Polygonaceae, Rosaceae, Asteraceae.
Флавоноиды представляют собой группу растительных пигментов, сочетание которых определяет ту или иную окраску цветков и плодов.
В растениях флавоноидные красители играют роль светофильтров, защищающих ткани от отрицательного влияния ультрафиолетовых лучей. Подтверждением этому может служить тот факт, что разбавленный раствор кверцитина или апигенина почти целиком поглощает излучение в ультрафиолетовой части спектра.
Флавоноиды участвуют в процессе дыхания растений: совместно с аскорбиновой кислотой принимают участие в ферментативных окисльно-восстановительных процессах.
Локализуются флавоноиды главным образом в листьях, цветках и плодах, реже в стеблях и подземных органах. В растениях большинство флавоноидов (за исключением катехинов и лейкоцианидинов2) присутствует в виде гликозидов, растворенных в клеточном соке. Сахарная часть в флавоноидных гликозидах представлена D-глюкозой, D-галактозой, D-маннозой, L-арабинозой и L-рамнозой. Из уроновых кислот обычно встречается D-глюкуроновая кислота. Присоединение сахаров происходит обычно по месту расположения гидроксилов в положении С-3 или С-7. Значительно реже возможно присоединение углеводного компонента в положении С-3¢ или С-4¢.
Классификация флавоноидов. Классификацияфлавоноидов производится по следующим признакам. 1. Местоположение бокового фенильного радикала; 2. Структура и степень окисленности пропанового фрагмента.
По пкрвому признаку различают следующие основные группы флавоноидов.
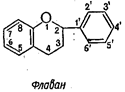
1. Собственно флавоноиды (эуфлавоноиды) с боковым фенильным радикалом у С-2;
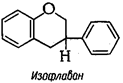
2. Изофлавоноиды с боковым фенильным радикалом у С-3;
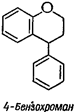
3. Неофлавоноиды с боковым фенильным радикалом у С-4;
4. Бифлавоноиды - конденсированная система из двух молекул флавоноидов, соединенных по С-5’ - C-8 углеродным атомам:
 |  |  | 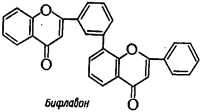 |
Подробно рассмотрим эуфлавоноиды, поскольку представители этой группы наиболее широко используются в медицинской практике.
По степени окисленностипиранового кольца (пропанового фрагмента) эуфлавоноиды подразделяют на две подгруппы - производные флавона и производные флавана:
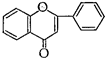 | 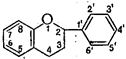 |
Флавон Флаван
В свою очередь в подгруппе флавона выделяют производные флавонола, а в подгруппе флавана - производные флаванона, флаванонола, катехина, лейкоцианидина и антоцианидина:
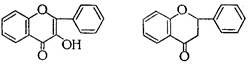 | 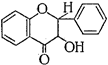 |
Флавонол Флаванон Флаванонол
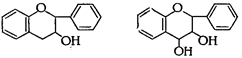 | 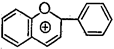 |
Катехин Лейкоцианидин Антоцианидин
К эуфлавоноидам относятся также соединения с видоизмененным пирановым циклом - халконы и ауроны:
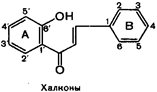 | 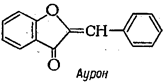 |
Биогенез флавоноидов в растениях. Известны два основных пути образования в растениях фенольных соединений: шикиматный путь – обязательным участником этого процесса является шикимовая кислота; и ацетатномевалоновый путь - связанный с промежуточным синтезом поликетидных (ацетатных) соединений и часто протекающий с участием мевалоновой или малоновой кислот.
Флавоноиды, как группа фенольных соединений, синтезируется по смешанному шикиматно-ацетатномевалоновому пути: кольцо В и трехуглеродный фрагмент – по шикиматному, а кольцо А флавоноидов – по ацетатно-мевалоновому. Необходимо отметить, что конечные продукты синтеза существуют в виде активных форм: кумароилконзима А и малонилкоэнзима А соответственно.
Схематично биосинтез флавоноидов в растениях можно представить следующим образом (некоторые промежуточные продукты биогенеза опущены).
1. Шикиматный отрезок пути биогенеза флавоноидов:
| Крахмал (гликолиз) ® Глюкоза ® Глюкозо-6-фосфат ® … | 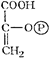 Фосфоенол-пируват Фосфоенол-пируват | + | 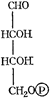 Эритрозо-4-фосфат[3] Эритрозо-4-фосфат[3] | ® | |||||
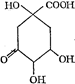 5-дегидрохинная кислота 5-дегидрохинная кислота | + АТФ ® … + СН3СООН | 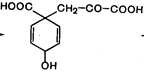 Префеновая кислота Префеновая кислота | + NH3 ® … - СО2 | 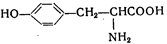 Тирозин Тирозин | |||||
| - NH3 ® … | 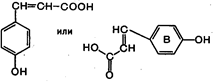 Кумаровая кислота Кумаровая кислота | ||||||||
2. Ацетатно-мевалоновый отрезок пути биогенеза флавоноидов:
| Крахмал (гликолиз) ® Глюкоза ® Глюкозо-6-фосфат ® … Фосфоенолпируват ® СН3СОСООН Пировиноград- ная кислота | ||
| + 2СН3СО~S-СоА + 2НООС-СН2-СО~S-Co A ® СН3СО~S-СоА ® ® НООС-СН2-СО~S-Co A ® Ацетилкоэнзим А - 2HSCo A Малонилкоэнзим А | ||
| ® | 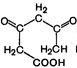 | Триуксусная кислота |
3. Заключительная стадия биогенеза флавоноидов.
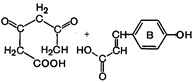 | - Н2О ® | 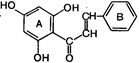 Халкон Халкон | ® | Все остальные группы флавоноидов |
Физико-химические свойства флавоноидов. Большинство флавоноидов в чистом виде - кристаллические вещества с фиксированной температурой плавления, горького вкуса, бесцветные или окрашенные в желтый, красный или синий цвет с зависимости от рН среды. Они, как правило, хорошо растворимы в полярных растворителях, в метаноле, бутаноле и растворах щелочей.
Флавоноидные гликозиды растворимы в воде, но агликоны в воде обычно растворяются плохо. Большинство агликонов флавоноидов растворимы в ацетоне, этилацетате, хлороформе и других гидрофобных растворителях.
Наличие фенольных гидроксильных групп обусловливает кислые свойства флавоноидов и их способность к образованию фенолятов в щелочной среде.
Благодаря наличию фенольных гидроксилов флавоноиды легко окисляются. Легкая окисляемость флавоноидов способствует восстановлению других веществ в реакционной смеси или препятствует их окислению. Такое свойство флавоноидов называется антиокислительным или антиоксидантным. Флавоноидные антиоксиданты способны даже в незначительных количествах сильно угнетают процессы окисления.
Флавоноидные гликозиды обладают оптической активностью и способностью избирательно поглощать свет в ультрафиолетовой части спектра в зоне длин волн 250-280 нм, что обусловлено наличием в молекуле фалавоноидов двух или более бензольных колец. Одна из характерных особенностей флавоноидных гликозидов - это способность к кислотному и ферментативному гидролизу, причем условия и скорость гидролиза специфичны для различных групп гликозидов. Например, флавонол-3-гликозиды легко гидролизуются при нагревании с разбавленными (0,2-1%) минеральными кислотами, флавон-7-гликозиды гидролизуются лишь при нагревании с 5-7% минеральными кислотами, а флавоноидные С-гликозиды гидролизуются только смесью концентрированных соляной и уксусной кислот (смесь Килиани).
Выделение флавоноидов из растительного сырья. Для флавоноидов не существует универсального метода выделения из растительного сырья, так как они очень сильно различаются по своей растворимости в воде или органических растворителях. В каждом конкретном случае прибегают к наиболее подходящему методу или сочетанию методов с учетом свойств выделяемых веществ, свойств возможных сопутствующих соединений и особенностей растительного сырья. Наиболее часто применяют избирательную экстракцию, осаждение солями тяжелых металлов и хроматографические методы.
С целью удаления из сырья липофильных примесей, его предварительно обрабатывают петролейным эфиром или четыреххлористым углеродом. Затем проводят экстракцию флавоноидов одним из подходящих растворителей: этанолом, метанолом, горячей водой или смесью хлороформа со спиртом.
Для предварительного суждения о содержании в исследуемых видах растений флавоноидов обычно используют следующий способ их выделения.
Навеску суховоздушных частей растения обрабатывают 70% этанолом или метанолом. Настаивают в течение суток, или проводят извлечение в аппарате Сокслета, или кипятят в течение 30 мин с обратным холодильником. Полученные спиртовые извлечения хроматографируют на бумаге или в тонком слое сорбента, а затем хроматограммы проявляют соответствующим реагентом.
При таком способе извлечения наряду с суммой флавоноидов экстрагируется большое количество сопутствующих веществ, отделение которых производят, как правило, хроматографическими приемами. Наиболее часто с этой целью применяют колоночную хроматографию, используя в качестве носителя полиамид, целлюлозу или силикагель. Элюирование проводят с помощью водных растворов метанола или этанола в различных концентрациях или смесью этилацетата и этанола (метанола).
Контроль за ходом разделения флавоноидов проводят методом хроматографии в тонком слое или на бумаге.
Качественный анализ сырья, содержащего флавоноиды. Флавоноидные соединения в растительном сырье обнаруживают качественными реакциями в водных или спиртовых извлечениях. Общие реакции, специфичные для всех групп флавоноидов, отсутствуют. Наиболее часто используют следующие реакции.
1. Цианидиновая проба или проба Chinoda - реакция восстановления препарата атомарным водородом в кислой среде в присутствии магния. При этом развивается окраска от оранжевой до красно-фиолетовой, что зависит от количества и местоположения оксигрупп.
Если заменить магний на цинк, то это приводит к изменению окраски, кроме того, отрицательной оказывается реакция на флавононы. Цианидиновую пробой не обнаруживаются халконы и ауроны.
2. Взаимодействие со щелочами. Эта реакция проводится для определения основного структурного типа флавоноидов, для определения числа и ориентации гидроксильных групп. Так например, с раствором аммиака флавоны, флавонолы, флаваноны и флаванонолы дают желтое окрашивание, при нагревании переходящее в оранжевое или красное. Халконы и ауроны дают красное или пурпурное окрашивание. Антоцианы - синее или фиолетовое.
3. Реакция с минеральными кислотами. При действии на флавоны и флавонолы минеральных кислот образуются интенсивно-желтые соли оксония.
4. Реакция с солями тяжелых металлов. Флавоны, халконы, ауроны, содержащие свободную ортогидроксильную группу в кольце В, при обработке их ацетатом свинца окрашиваются в ярко-желтый цвет.
Флавоноидные соединения, содержащие эти группировки, образуют ярко окрашенные комплексы с ионами таких металлов, как алюминий, цирконий, причем эти комплексы часто имеют яркую флуоресценцию в УФ свете, что используется при исследовании флавоноидных соединений методом хроматографии на бумаге и в тонком слое.
5. Проба с треххлористой сурьмой. Халконы с раствором треххлористой сурьмы в четыреххлористом углероде окрашиваются в красный или красно-фиолетовый цвет, флавоны - в желтый или желто-оранжевый.
6. Реакция с реактивом Вильсона (борная и лимонная кислота, растворенные в безводном ацетоне). С реактивом Вильсона флавоны и флавонолы образуют желтую окраску с красноватой флуоресценцией в УФ свете.
Флавоноиды можно обнаружить путем просмотра результатов хроматографии на бумаге в ультрафиолетовом свете. При этом флавоны, флавонол-3-гликозиды, флаваноны и халконы обнаруживаются в виде коричневых пятен; флавонол-7-гликозиды - желтых или желто-зеленых пятен.
Количественное определение флавоноидов. Для определения количественного содержания флавоноидов в сырье используют различные методы: химические, физические, физико-химические.
Наличие фенольных гидроксилов, обусловливающих слабокислотные свойства флавоноидов, позволяет использовать для анализа метод кислотно-основного титрования в неводных средах.
Флавоноиды обладают значительной интенсивностью поглощения в УФ-области спектра. Это свойство используется при спектрофотометрических методах количественного определения.
Широко применяются фотометрические методы, основанные на измерении интенсивности окрашивания продуктов реакции флавоноидов с различными реагентами. Наиболее часто для этой цели используются соли алюминия, хрома, циркония и т.д. Метод дает стабильные результаты, однако он не обладает специфичностью и требует предварительного разделения флавоноидов.
Существуют и другие методы количественного определения флавоноидов - флуориметрические, полярографические, комплексонометрические, но используются они довольно редко.
Наиболее точным, приемлемым методом количественного определения флавоноидов является хроматоспектрофотометрический, основанный на разделении этих веществ хроматографией на бумаге или в тонком слое с последующим установлением их содержания в элюатах.
 2014-05-17
2014-05-17 14141
14141








