Константы равновесия Кр и Кс остаются постоянными только при Т= const, с изменением температуры Кр и Кс изменяются.
Зависимость константы равновесия от температуры можно найти, продифференцировав уравнение 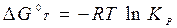 :
:
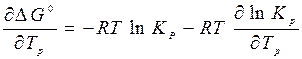
подставим уравнение Гиббса-Гельмгольца 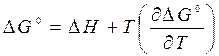
в полученное и с учетом исходного уравнения и перехода от частных производных к полным, получим
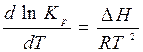
Это уравнение называется уравнением изобары химической реакции, по нему можно определить смещение химического равновесия при изменении температуры. Так, из уравнения следует, что при повышении температуры dT> 0, d ln Kp > 0 для тех реакций, в которых АН > 0, т. е. при повышении температуры равновесие смещается в сторону эндотермической реакции. При понижении температуры dT< 0, d ln K > 0 для тех реакций, в которых ∆H < 0, т. е. при понижении температуры равновесие смещается в сторону экзотермических реакций.
Если процесс протекает при V= const, то, проделав те же операции, получим уравнение изохоры химической реакции:
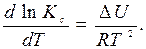
Разделив переменные в уравнении изобары, получим
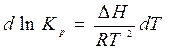
Если предположить, что (в простейшем случае) в каком-либо интервале температур тепловой эффект реакции не зависит от температуры, то полученное уравнение можно проинтегрировать в этом интервале температур:
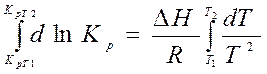
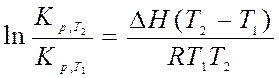
В координатах ln Кр — 1/T зависимость Кр от температуры является линейной, при этом тангенс угла наклона этой прямой равен тепловому эффекту реакции tgα = ∆H/R. Зная тепловой эффект химической реакции и константу равновесия при какой-либо температуре T1(Kp,T1), можно определить константу равновесия при любой другой температуре.
Влияние давления на равновесие химической реакции (уравнение Планка)
Константа Кр не зависит от общего и парциальных давлений равновесной системы, также, как константа Кс не зависит от концентрации компонентов. В реальных газах и растворах аналогичные константы Кa и Кf не зависят от общего давления и состава.
Для выяснения влияния давления на химическое равновесие используют константу равновесия, выраженную через молярные доли компонентов.
Подставим в уравнение для Кр значения парциальных давлений, выраженные через мольные доли компонентов Xi (в соответствии с законом Дальтона):
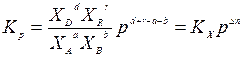 ,
,
где р – общее давление в системе.
Логарифмируя полученное уравнение и дифференцируя его по давлению получаем
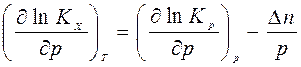
Учитывая, что объем смеси идеальных газов, согласно уравнению Менделеева-Клайперона,
p∆V=∆nRT
и что Кр не зависит от давления, получаем
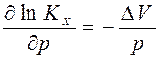
Полученное соотношение называется уравнением Планка. Оно показывает, что если реакция сопровождается уменьшением объема (∆V – отрицательная величина), то КХ возрастает с увеличением давления и наоборот, если ∆V – положительная величина, то константа уменьшается с ростом давления.
 2014-05-17
2014-05-17 9418
9418
