Состояние системы, которое не изменяется во времени и ничем не поддерживается, называется равновесным.
При протекании химических реакций при определенных внешних уловиях наступает такой момент, когда число молекул веществ, составлящих систему, перестает изменяться и остается постоянным при неизменных внешних условиях. Такое состояние называется химическим равновесием.
Рассмотрим при заданных условиях какую-либо систему, в которой происходят как прямая, так и обратная реакции, где скорость прямой peaкции равна скорости обратной (Wпр = Wобр):
аА + вВ ↔ dD + rR
Пусть все участвующие в реакции вещества находятся в газообразном состоянии, каждое из которых характеризуется своим равновесным давлением рА, рВ, pD, рR. В условиях равновесия dG = 0, тогда для полного дифференциала энергии Гиббса имеем
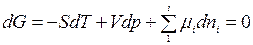
При Т= const и р = const
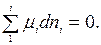
Подставим значения химических потенциалов веществ, образующих в систему, в последнее уравнение:
dμD + rμR – aμA – bμB =0
Учитывая, что μi = μi ° + RTlnp, подставляем значения химических потенциалов всех реагирующих веществ в последнее уравнение, отсюда
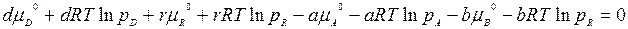
сгруппировав члены равенства, имеем
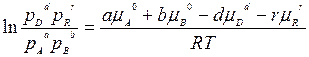
В правой части этого уравнения стоит величина, зависящая только от температуры и давления. Поскольку процесс идет в изобарно-изотермических условиях, эта величина будет постоянной. Обозначим ee lnКр,, тогда
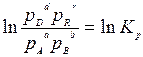 →
→ 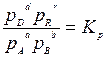
где Кр -константой равновесия химической реакции протекающей между газообразными веществами.
Если химический потенциал выразить через концентрацию
μi = μi 0 + RT ln сi, то, проделав аналогичные операции, получим
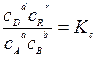
Константы Кр, и Кc определяют выход химической реакции. Под выходом понимают долю исходного вещества, превратившегося в конечный продукт. Если Кр >>1или Кc >>1,то в данной системе велик выход продуктов реакции.
Уравнения для Кр и Кc называют законом действующих масс (ЗДМ), выведенным на основе термодинамики. Для газов из уравнения Менделеева-Клапейрона:
piVi= niRT; pi(ni/Vi)RT=ciRT.
Подставив последнее выражение в уравнение ЗДМ для Кр, получим уравнение взаимосвязи Кр и Кc
Kp=Kc(RT)∆n,
где ∆n – изменение количества вещества (в моль) в реакции.
При ∆n = 0
H2 +Cl2 ↔ 2HCl, Кр=Кc или 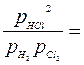
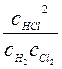
При ∆n < 0
2СО + О2↔2СО2, Кр< Кс или 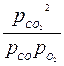 <
< 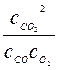
При ∆n >0
2NH3 ↔ 3Н2 + N2, Kp > Кс или 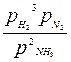 <
< 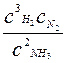
Для реальных растворов используют константу равновесия Ka, рассчитываемую через активности:
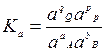
Активность а – это концентрация реального раствора, которая учитывает размеры и взаимодействия частиц реагирующих веществ.
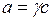 ,
,
где 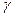 - коэффициент активности. Значение
- коэффициент активности. Значение 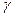 для разных веществ при разных концентрациях их растворов приведены в аналитических и физико-химических справочниках.
для разных веществ при разных концентрациях их растворов приведены в аналитических и физико-химических справочниках.
Для учёта взаимодействия частиц реального газа используют коэффициент фугетивности φ, а вместо давлений величину фугетивности f = φp.
Поэтому равновесие в реальных газах характеризует константой 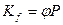 .
.
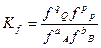 .
.
Приведенные уравнения для расчета Кр, Кc, КN, Кa и Кf справедливы для гомогенных систем.
При выводе ЗДМ мы рассматривали гомогенные системы, в которых все компоненты находятся в газообразном состояние или в растворе. Реакции, в которых реагенты находятся в разных фазах называются гетерогенными. Ограничимся рассмотрением наиболее простых гетерогенных равновесий, в которых каждое вещество содержится системе в виде самостоятельной фазы, т.е. не образует жидких или твердь растворов.
Пусть в реакции аА + bВ = dD + rR вещество D находится в кристаллическом состоянии, тогда аналогично предыдущему получим:
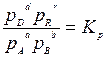
где рD — давление насыщенного компонента D, являющееся постоянно величиной.
Включая рD в константу Кр, получаем
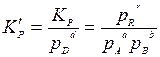
 2014-05-17
2014-05-17 5726
5726
