Способность веществ вступать в химическую реакцию называется химическим сродством. Начало современной теории термодинамического сродства положили У. Гиббс и Г. Гельмгольц, а Я. Вант-Гофф развил эту теорию и обосновал ее математически.
Химическое сродство зависит от природы, температуры и концентрации реагирующих веществ, а для газов – от давлений. За меру химического сродства при данной температуре Т принимают изменение изобарно-изотермического потенциала 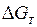 (энергия Гиббса) или изохорно-изотермический потенциал
(энергия Гиббса) или изохорно-изотермический потенциал 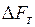 (энергия Гельмгольца).
(энергия Гельмгольца).
В замкнутой системе при U = const и V = const самопроизвольный процесс происходит с ростом энтропии и соответственно сопровождается убылью энергии Гиббса или энергии Гельмгольца. Отсюда следует принцип, сформулированный Вант-Гоффом, что максимальная полезная работа химической реакции является мерой химического сродства.
Для нахождения максимальной работы реакции надо провести процесс термодинамически обратимо при постоянных температуре и давлении. Рассмотрим уже известную нам реакцию:
аА + ЬВ ↔ dD + rR
протекающую в газовой фазе и находящуюся в данный момент времени в неравновесном состоянии. Участники реакции характеризуются неравновесными парциальными давлениями: рА, рB, pD, pR и химическими потенциалами: μA, μB, μD, μR.
Для проведения реакции термодинамически обратимо необходимо взять такие количества реагирующих веществ, чтобы исчезновение а моль вещества A, b моль вещества В и появление d молей вещества D и r молей вещества R существенно не изменило состояние реакции.
При этих условиях реакция будет протекать очень медленно, так что любое состояние системы будет мало отличаться от состояния равновесия. Следовательно, количественное описание системы можно осуществлять термодинамическими методами.
Так как реакция протекает при р = const и Т = const (начальные условия), то в данном случае характеристической функцией будет энергия Гиббса, изменение которой при переходе из неравновесного (начального) в равновесное (конечное) состояние определяется условием:
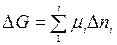
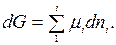
Заменим и. их значениями и запишем полное изменение G в процессе этого перехода (неравновесное состояние → равновесное состояние):
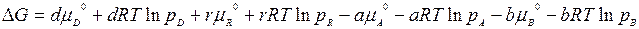
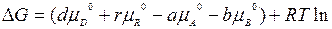
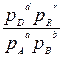
Учитывая, что 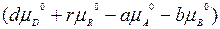 = - RT ln Kp, из уравнения получаем
= - RT ln Kp, из уравнения получаем
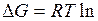
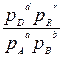 - RT ln Kp
- RT ln Kp
или
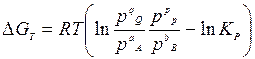 .
.
Максимальная полезная работа реакции
А'  = -
= - 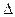 G → А'
G → А'  =
= 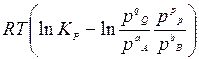
Если реакция протекает при Т= const и V= const, то
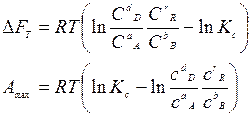
Эти термодинамические соотношения называют уравнениями изотермы химической реакции (изотермы Вант-Гоффа). В них Кс и Кр – константы равновесия реакции при температуре; С и р – неравновесные концентрации и давления реагирующих веществ.
Изотермы химической реакции дают возможность определять в каком направлении, и до какого предела характеризуемого химическим равновесием может протекать реакция при данных условиях 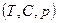 . При помощи этих уравнений можно определить, какими должны быть температура и состав исходной смеси, чтобы реакция протекала в нужном направлении и с определённым выходом продукта. В вычисленных значениях
. При помощи этих уравнений можно определить, какими должны быть температура и состав исходной смеси, чтобы реакция протекала в нужном направлении и с определённым выходом продукта. В вычисленных значениях 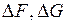 знак “-” указывает на возможность самопроизвольного протекания реакции в прямом направлении, а знак “+” показывает, что данная реакция может самопроизвольно протекать только в обратном направлении.
знак “-” указывает на возможность самопроизвольного протекания реакции в прямом направлении, а знак “+” показывает, что данная реакция может самопроизвольно протекать только в обратном направлении.
На практике часто используют стандартное химическое сродство. При условии, когда парциальные давления всех веществ рА = рB = pD = pR = 1 атм, из уравнения получим
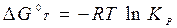 ,
,
где 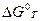 - это энергия Гиббса, когда парциальное давление всех компонентов реакционной газовой смеси равны 1 атм.
- это энергия Гиббса, когда парциальное давление всех компонентов реакционной газовой смеси равны 1 атм.
Аналогично, при Т = const и V = const
F0 = - RТ ln Кс.
Сравнивая G0 и F 0 различных веществ, можно получить характеристику степени их удаленности от состояния равновесия при сi = 1моль/л или pi = 1 атм.
Чем больше отрицательные значения G0 или F 0, тем больше К и тем полнее пойдет реакция. Если G0 (или F 0) - большая положительная величина, то константа равновесия мала и равновесие сильно сдвинуто в сторону исходных веществ.
Пользуясь величиной G0 (или F 0), нельзя забывать, что она показывает направление реакции при вполне определенных значениях парциальных давлений газообразных веществ. Приводимые в справочной литературе числовые значения G0 обычно относятся к стандартной температуре (298 К).
 2014-05-17
2014-05-17 17079
17079
