Кинетическая модель реакции или кинетические уравнения – это функциональная зависимость скорости реакции или скорости превращения веществ от условий ее протекания (концентрации реагентов, температуры, давления и др.).
Если реакция или ее этап протекает при одном взаимодействии исходных веществ, то кинетическое уравнение для реакции:
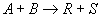
описывается с использованием закона действующих масс:

где 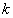 - константа скорости реакции.
- константа скорости реакции.
Если реакция или ее этап –многостадийные, то кинетическое уравнение может иметь иную форму. Константа скорости реакции зависит только от температуры в соответствии с законом Аррениуса:

где 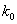 - предэкспоненциальный множитель;
- предэкспоненциальный множитель; 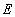 - энергия активации, Дж/моль;
- энергия активации, Дж/моль; 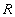 - газовая постоянная.
- газовая постоянная.
Зависимость константы скорости реакции от температуры представлена на рис. 5.
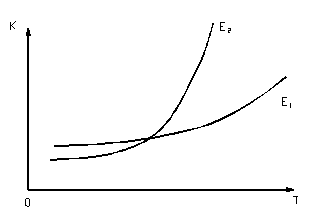
Рис. 5. Зависимость константы скорости от температуры
Для обратимой реакции вида 
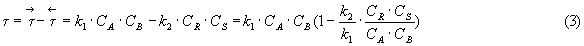
где 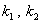 - константы скорости реакции в прямом и обратном направлении.
- константы скорости реакции в прямом и обратном направлении.
При достижении равновесия 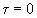
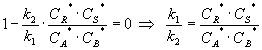 .
.
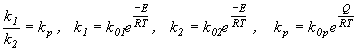
В результате получим

где 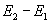 - разность между энергиями активации обратимой реакции в прямом и обратном направлениях. Она равна тепловому эффекту реакции. Поэтому для экзотермического процесса
- разность между энергиями активации обратимой реакции в прямом и обратном направлениях. Она равна тепловому эффекту реакции. Поэтому для экзотермического процесса 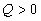 и
и 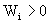 ; для эндотермической
; для эндотермической 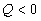 и
и 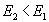 .
.
В общем случае кинетическое уравнение химической реакции можно представить в виде:

где 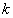 - константа скорости реакции;
- константа скорости реакции; 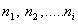 - порядок реакции по соответствующим реагирующим веществам;
- порядок реакции по соответствующим реагирующим веществам; 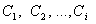 - концентрации веществ, участвующих в реакции. Общий порядок реакции равен
- концентрации веществ, участвующих в реакции. Общий порядок реакции равен 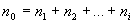 . Если скорость реакции прямолинейно зависит от
. Если скорость реакции прямолинейно зависит от 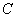 и
и 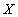 , то реакция является первого порядка.
, то реакция является первого порядка.
 2014-09-02
2014-09-02 1679
1679
