Гидролизом соли называется взаимодействие ионов растворенной соли с ионами воды, сопровождающееся изменением pH раствора. Гидролиз может происходить только тогда, когда из ионов соли и ионов воды образуются малодиссоциированные вещества.
Гидролизу подвергаются соли, образованные:
а) сильным основанием и слабой кислотой (гидролиз по аннону);
б) слабым основанием и сильной кислотой (гидролиз но катиону);
в) слабым основанием и слабой кислотой (гидролиз по катиону и аниону).
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
Уравнения гидролиза пишутся аналогично другим ионным уравнениям: малодиссоциированные (в том числе и вода) и малорастворимые, а также газообразные вещества пишутся в виде молекул, сильные электролиты записываются в виде ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням.
Пример 1. Гидролиз по аниону соли 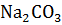
I ступень: 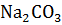 +
+ 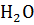

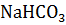 + NaOH
+ NaOH
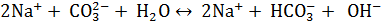
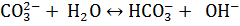
II ступень: 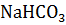 +
+ 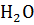

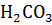 + NaOH
+ NaOH
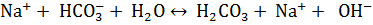
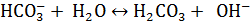
В результате гидролиза соли по аниону образуется слабая кислота, а накопление 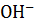 приводит к тому, что pH становится > 7.
приводит к тому, что pH становится > 7.
Пример 2. Гидролиз по катиону соли 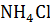
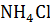
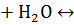
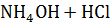
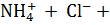
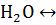

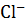
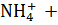
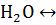
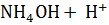
В результате гидролиза соли по катиону образуется слабое основание, а накопление ионов водорода приводит к тому, что pH раствора становится < 7.
Пример 3. Гидролиз по катиону и аниону соли 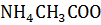
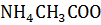
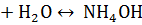 +
+ 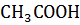
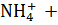
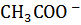
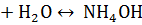 +
+ 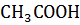
В результате гидролиза образуются слабое основание и слабая кислота, накопления 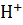 и
и 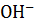 не происходит и pH
не происходит и pH 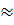 7.
7.
Количественной оценкой гидролиза является степень 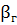 и константа гидролиза
и константа гидролиза 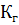 .
.
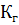 равна отношению произведения концентраций продуктов гидролиза к концентрации негидролизованной соли.
равна отношению произведения концентраций продуктов гидролиза к концентрации негидролизованной соли.
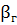 равна отношению концентрации гидролизированной соли (
равна отношению концентрации гидролизированной соли (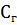 ) к концентрации растворенной соли (с)
) к концентрации растворенной соли (с) 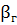 =
= 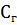 / с, откуда
/ с, откуда 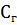 = c
= c 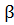 .
.
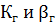 связаны между собой отношением, аналогичным закону разбавления:
связаны между собой отношением, аналогичным закону разбавления:
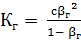 .
.
При малых значениях 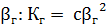 , откуда
, откуда 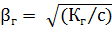 .
.
Константа гидролиза 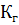 и степень гидролиза
и степень гидролиза 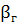 связаны с ионным произведением воды
связаны с ионным произведением воды 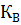 и концентрацией гидролизирующейся соли С следующими соотношениями:
и концентрацией гидролизирующейся соли С следующими соотношениями:
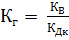 ;
; 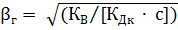 ;
;
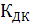 – константа диссоциации кислоты.
– константа диссоциации кислоты.
б) гидролиз по аниону:
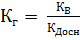 ;
; 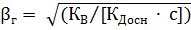 ;
;
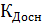 – константа диссоциации основания.
– константа диссоциации основания.
в) гидролиз по катиону и аниону:
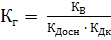 ;
; 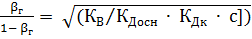 .
.
Пример 1. Вычислить константу гидролиза 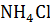 .
.
Решение. Из таблицы находим 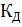 (
(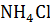 ) = 1.8
) = 1.8 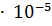 . Отсюда
. Отсюда
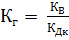
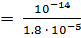 = 5.56
= 5.56 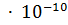 .
.
Пример 2. Вычислить степень гидролиза 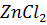 по I ступени в 0.5 М растворе.
по I ступени в 0.5 М растворе.
Решение. Ионное уравнение гидролиза:
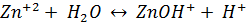 ;
;
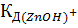 = 1.5
= 1.5 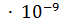 ;
;
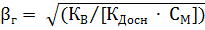 =
= 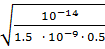 = 0.36
= 0.36  (0.36%).
(0.36%).
 2015-01-13
2015-01-13 1186
1186
