Зависимость скорости химической реакции от температуры описывается уравнением Вант-Гоффа.
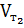 =
= 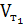
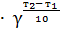 или
или 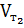 =
= 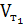
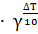
где 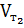 – скорость реакции при температуре
– скорость реакции при температуре 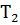 ;
;
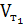 – скорость реакции при температуре
– скорость реакции при температуре 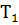 ;
;
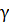 – температурный коэффициент скорость реакции, равный обычно 2-4. Показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10
– температурный коэффициент скорость реакции, равный обычно 2-4. Показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10  .
.
При увеличении температуры на каждые 10  скорость химической реакции увеличивается в 2-4 раза. Точнее зависимость скорости реакции от температуры выражается уравнением Аррениуса:
скорость химической реакции увеличивается в 2-4 раза. Точнее зависимость скорости реакции от температуры выражается уравнением Аррениуса:
К = С 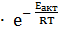 ,
,
где k – константа скорости реакции;
С – постоянная;
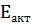 – энергия активации;
– энергия активации;
R – универсальная газовая постоянная;
Уравнение Аррениуса для двух температур 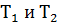 может быть записано после преобразований в удобной для вычислений логарифмической форме:
может быть записано после преобразований в удобной для вычислений логарифмической форме:
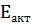 = 4,58lg(
= 4,58lg(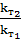 )
) 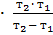 (кал
(кал 
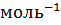 )
)
где 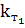 и
и 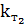 – константа скорости химических реакций при температурах
– константа скорости химических реакций при температурах 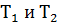 .
.
Пример 1. Определение изменения скорости реакции при изменении температуры.
Вычислить, во сколько раз возрастет скорость реакции при повышении температуры с 20  до 40
до 40  . Температурный коэффициент скорости реакции равен 3.
. Температурный коэффициент скорости реакции равен 3.
Решение. 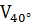 =
= 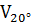
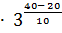 =
= 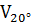
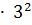 = 9
= 9 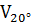
При повышении температуры с 20  до 40
до 40  С скорость реакции возрастет в 9 раз.
С скорость реакции возрастет в 9 раз.
Пример 2. Вычисление времени протекания реакции при изменении температуры.
При 353 К реакция заканчивается за 20 с. Сколько времени длится реакция при 293 К, если температурный коэффициент реакции 2,5?
Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость
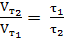 , откуда
, откуда 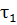 =
= 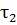
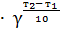 =
= 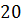
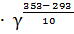 = 20
= 20 
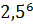 ;
;
lg 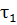 = lg20 + 6lg2,5 = 1,3010 + 6
= lg20 + 6lg2,5 = 1,3010 + 6  0,3979 = 3,6884;
0,3979 = 3,6884;
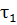 = 4879 с = 1ч 21мин 19с.
= 4879 с = 1ч 21мин 19с.
При температуре 293 К эта реакция заканчивается за 1ч 21мин 19с.
Пример 3. Вычисление энергии активации.
Константа скорости некоторой реакции при 20  равна 2
равна 2 
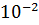 , а при 40
, а при 40  3,6
3,6 
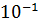 . Вычислить энергию активации.
. Вычислить энергию активации.
Решение. Выразим температуру в абсолютной шкале и подставим исходные данные в формулу.
Е = 4,58lg 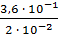
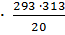 = 26380 кал.
= 26380 кал.
 2015-01-13
2015-01-13 4975
4975
