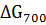 = 2,303
= 2,303  RT(lg
RT(lg 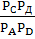 - lg
- lg 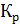 ).
).
Для данного процесса:
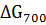 = 2,303
= 2,303  8,3144
8,3144  700(lg
700(lg 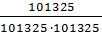 - lg1,0685
- lg1,0685 
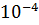 ) = 13403,65(lg
) = 13403,65(lg 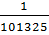 - lg1,0685
- lg1,0685 
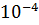 ) = -13862 Дж = -13,9 кДж
) = -13862 Дж = -13,9 кДж
Так как  G
G  <0, то реакция СО +
<0, то реакция СО + 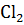 =
= 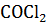 при 700 К возможна.
при 700 К возможна.
Пример 4. Смещение химического равновесия.
В каком направлении сместится равновесие с системе
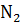 + 3
+ 3 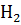

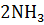 – 22 ккал:
– 22 ккал:
а) при увеличении концентрации 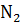 ;
;
б) при увеличении концентрации 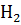 ;
;
в) при повышении температуры;
г) при уменьшении давления?
Решение. Увеличение концентрации веществ, стоящих в левой части уравнения реакции, по правилу Ле-Шателье должно вызвать процесс, стремящийся ослабить оказанное воздействие, привести к уменьшению концентраций, т.е. равновесие сместится вправо (случай а и б).
Реакция синтеза аммиака – экзотермическая. Повышение t вызывает смещение равновесия влево – в сторону эндотермической реакции, ослабляющей оказанное воздействие (случай в).
Уменьшение давления (случай г) будет благоприятствовать реакции, ведущей к увеличению объема системы, т.е. в сторону образования 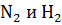 .
.
 2015-01-13
2015-01-13 465
465








