Состояние, при котором скорости прямой и обратной реакции равны между собой, называется химическим равновесием.
Уравнение обратимой реакции в общем виде
mA + nB  pC + qД
pC + qД
Скорость прямой и обратной реакции выражаются уравнениями
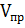 =
= 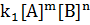 и
и 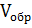 =
= 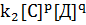 .
.
Так как при химическом равновесии 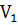 =
= 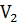 , то
, то
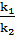 =
= 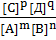 = K
= K
где К – константа химического равновесия, не зависящая от концентрации реагирующих веществ, но изменяющаяся с температурой. При К>1 произведение концентраций продуктов реакции больше произведения концентрации исходных веществ. Поэтому обратимая реакция дает в этом случае большой выход продуктов реакции. При К<1, наоборот, выход продуктов реакции очень мал.
В выражение константы равновесия входят концентрации веществ, находящиеся в газовой фазе.
Константа равновесия связана с изменением основных термодинамических характеристик соотношением -RTlnK =  G. Так как
G. Так как  G =
G =  Н - Т
Н - Т  S, то
S, то
RlnK =  S -
S - 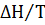 .
.
Если в уравнение -RTlnK =  G ввести значение R =8,31
G ввести значение R =8,31 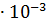 кДж
кДж 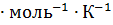 и перейти от натуральных логарифмов к десятичным, то оно примет вид lgK = -0,175
и перейти от натуральных логарифмов к десятичным, то оно примет вид lgK = -0,175 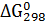 кДж
кДж 
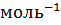 .
.
При отрицательных значениях  G (
G ( G<0) правая часть уравнения становится положительной и, следовательно, в этом случае lgK>0 и K>1.
G<0) правая часть уравнения становится положительной и, следовательно, в этом случае lgK>0 и K>1.
Чем больше отрицательные значения  G, тем численно больше константа равновесия и тем сильнее смещается равновесие вправо. При
G, тем численно больше константа равновесия и тем сильнее смещается равновесие вправо. При  G = 0 оба направления протекания обратимых реакций равновероятны. В этих случаях lgK = 0 и K = 1, т.е. произведение концентраций исходных веществ равно произведению концентраций продуктов реакций.
G = 0 оба направления протекания обратимых реакций равновероятны. В этих случаях lgK = 0 и K = 1, т.е. произведение концентраций исходных веществ равно произведению концентраций продуктов реакций.
Температуру, при которой  G
G  = 0, называют температурой начала реакции. При этой температуре прямая и обратная реакция равновероятны. Температура начала реакции позволяет судить о начале развития реакции в желаемом направлении. Так как
= 0, называют температурой начала реакции. При этой температуре прямая и обратная реакция равновероятны. Температура начала реакции позволяет судить о начале развития реакции в желаемом направлении. Так как  G
G  = 0,
= 0,  Н
Н  - Т
- Т  S
S  и
и 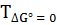 =
= 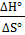 .
.
Химическое равновесие устанавливается при определенных значениях концентрации реагирующих веществ, температуры, давления для газов. Изменение одного из этих параметров приводит к нарушению равновесия. Направление смещения равновесия определяется правилом Ле-Шателье, согласно которому если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие (изменить температуру, концентрацию, давление), то это воздействие благоприятствует той из двух противоположных реакций, которая ослабляет оказанное воздействие.
Пример 1. Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ.
Вычислите константу равновесия реакции А + В  2С, если равновесные концентрации [A] = 0,3 моль
2С, если равновесные концентрации [A] = 0,3 моль 
 ;
; 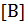 = 1,1 моль
= 1,1 моль 
 ; [С] = 2,1 моль
; [С] = 2,1 моль 
 .
.
Решение. Выражение константы равновесия для реакции имеет вид
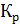 =
= 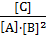
Подставим сюда указанные в условии задачи равновесные концентрации:
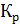 =
= 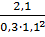 = 5,79.
= 5,79.
Пример 2. Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А + 2В  С.
С.
Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль 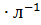 , а константа равновесия реакции
, а константа равновесия реакции 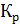 = 50.
= 50.
Решение. На каждый моль веществ А и В образуются 2 моль вещества С. Если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества С будет равно 2Х моль.
Равновесные концентрации реагирующих веществ будут:
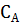 = (0,5-х) моль
= (0,5-х) моль 
 ;
;
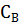 = (0,7-х) моль
= (0,7-х) моль 
 ;
;
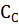 = 2х моль
= 2х моль 
 .
.
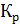 =
= 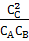 =
= 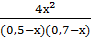 =
= 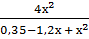 = 50
= 50
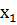 = 0,86;
= 0,86; 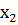 = 0,44.
= 0,44.
По уравнению задачи справедливо значение 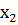 . Отсюда равновесные концентрации реагирующих веществ равны:
. Отсюда равновесные концентрации реагирующих веществ равны:
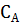 = 0,5 – 0,44 = 0,06 моль
= 0,5 – 0,44 = 0,06 моль 
 ;
; 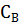 = 0,7 – 0,44 = 0,26 моль
= 0,7 – 0,44 = 0,26 моль 
 ;
;
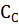 = 0,44
= 0,44  2 = 0,88 моль
2 = 0,88 моль 
 .
.
Пример 3. Определение изменения энергии Гиббса  G
G  реакции по значению константы равновесия
реакции по значению константы равновесия 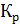 .
.
Рассчитайте энергию Гиббса и определите возможность протекания реакции СО + 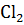 =
= 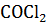 при 700 К, если константа равновесия равна
при 700 К, если константа равновесия равна 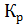 = 1,0685
= 1,0685 
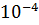 . Пропорциональное давление всех реагирующих веществ одинаково и равно 101325 Па.
. Пропорциональное давление всех реагирующих веществ одинаково и равно 101325 Па.
 2015-01-13
2015-01-13 1443
1443
