Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, разряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Ме + m Н2О 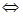 Ме(Н2О) n+m + ne -
Ме(Н2О) n+m + ne -
в растворе на металле
где n - число электронов, принимающих участие в процессе.
На границе металл — жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях – так называемые стандартные электродные потенциалы (Е°).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; ∆G0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е0), получаем ряд стандартных электродных потенциалов (ряд напряжений).
Положение того или иного металла в ряду стандартных электродных потенциалов (ряд напряжений) характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют приборами, которые называют гальваническими элементами. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае ∆G0 < 0, так как ∆G 0= - nFE0.
Пример 1. Определение электродного потенциала в зависимости от концентрации ионов металла в растворе
Стандартный электродный потенциал никеля больше, чем кобальта (табл.1). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта — в растворе с концентрацией 0,1 моль/л.
Решение. Электродный потенциал металла (Е) концентрации его ионов в растворе. Эта зависимость уравнения Нернста:
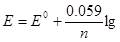 с,
с,
где Е° — стандартный электродный потенциал; n — число электронов, принимающих участие в процессе; с — концентрация (при точных вычислениях — активность) гидратированных ионов металла в растворе, моль/л; Е0 — для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при заданных концентрациях:
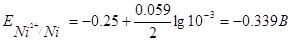
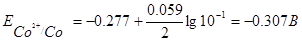
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Таблица 1
Стандартные электронные потенциалы(∆Е0)
 2015-01-13
2015-01-13 672
672







