Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением H=U+PV, где V – объем системы.В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса: Qр = ∆H; ∆H=∆U+P∆V. Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так: 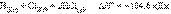 При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:
При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии: 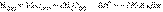
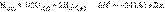 .Приведенные энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (P = 101,325 кПа) и взяты для температуры T = 298 K. Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами:
.Приведенные энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (P = 101,325 кПа) и взяты для температуры T = 298 K. Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами: 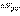 нижний индекс обычно опускают: Δ
нижний индекс обычно опускают: Δ  .
.
Энтальпия образования (теплота образования), энтальпия реакции образования данного вещества (или раствора) из заданных исходных веществ. Энтальпией образования химических соединения называют энтальпию реакции образования данного соединения из простых веществ. В качестве простых веществ выбирают химические элементы в их естественном фазовом и химическом состоянии при данной температуре. Так, при 298 К для хлора простым веществом служит газообразный хлор, состоящий из молекул С12, а для калия - металлический калий. Энтальпия образования твердого КСl при 298 К - это энтальпия реакции: К(тв.) + 1/2Сl2= КСl(тв.).Энтальпия образования КСl (тв.) при 500 К соответствует реакции: К(жидкий) + 1/2Cl2 = КСl(тв.), так как естественным фазовым состоянием (простым веществом) для калия становится уже не кристалл, а жидкость (т-ра плавления К 336,66 К).
Энтальпия образования может быть определена при любой температуре. Стандартные энтальпии образования 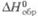 соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении 1 атм (1,01 x 105 Па). По определению, для всех простых веществ при любой температуре
соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении 1 атм (1,01 x 105 Па). По определению, для всех простых веществ при любой температуре 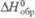 = 0. Для большинства хим. соед. энтальпия образования- отрицат. величины.
= 0. Для большинства хим. соед. энтальпия образования- отрицат. величины.
Единицы измерения энтальпии образования - Дж/г, Дж/моль.В термодинамике растворов (расплавов) под энтальпией образования понимают изменение энтальпии при изотермо-изобарном образовании 1 моля (1 г) раствора (расплава) данного состава из чистых компонентов. Так, в двухкомпонентной системе KF-A1F3 энтальпия образования расплава 50 %-ного молярного состава соответствует процессу: 1/2КF(жидкий) + 1/2А1F3(жидкий) = КF-А1F3(расплав, 50 мол. %).
Эндотерми́ческие реа́кции (от др.-греч. ἔνδον — внутри и θέρμη — тепло) — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (ΔH > 0, ΔU > 0), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.К эндотермическим реакциям относятся: реакции восстановления металлов из оксидов, электролиза (поглощается электрическая энергия),электролитической диссоциации (например, растворение солей в воде),ионизации, фотосинтеза.Эндотермические реакции противоположны экзотермическим реакциям.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:ΔH = энергия, потраченная на разрыв связей — энергия, выделенная при образовании связей продуктов реакции.Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, например: 2H2 + O2 → 2 H2O изменение энтальпии равно ΔH = −483.6 кДж на один моль O2.
ПРИМЕРЫ
Горение топлива в кислороде воздуха.
Горение пороха.
Добавление концентрированной серной кислоты в воду.
Окисление жиров и углеводов в живых организмах.
Адиабатическое горение
 2015-01-13
2015-01-13 6419
6419
