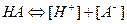 сильная кислота
сильная кислота
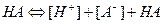 слабая кислота
слабая кислота
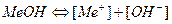 сильный гидроксид
сильный гидроксид
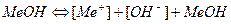 слабый гидроксид
слабый гидроксид
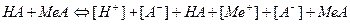
слабая кислота и ее соль
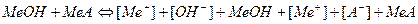 слабое основание и его соль
слабое основание и его соль
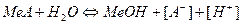 соль, образованная
соль, образованная
слабым основанием и сильной кислотой
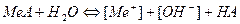 соль, образованная
соль, образованная
сильным основанием и слабой кислотой
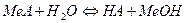 соль, образованная слабым
соль, образованная слабым
основанием и слабой кислотой
Взаимодействие солей с водой, при котором составные части вещества соединяются с составными частями воды, называется гидролизом солей. «Гидролиз» дословно означает «разложение водой». Можно записать выражение для расчета константы гидролиза:
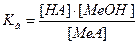 (24)
(24)
Значение константы гидролиза (Кг) характеризует способность данной соли подвергаться гидролизу. Чем больше величина Кг, тем в большей степени протекает гидролиз.
В случае соли, образованной слабой кислотой и сильным основанием константу гидролиза можно записать как:
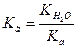 (25)
(25)
Чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли. Для солей, образованных слабым основанием и сильной кислотой константа гидролиза имеет вид:
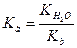 (26)
(26)
Чем слабее основание, тем в большей степени подвергаются гидролизу его соли. Для солей, образованных слабой кислотой и слабым основанием для константы гидролиза имеем следующее выражение:
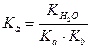 (27)
(27)
Во всех этих формулах величина 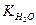 представляет собой ионное произведение воды
представляет собой ионное произведение воды
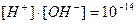 .
.
Для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов является постоянной величиной. Если концентрация ионов водорода равна концентрации ионов гидроксида, то такой раствор называется нейтральным.
Летучесть
Летучесть или фугитивность есть физическая величина, имеющая размерность давления. В этом случае стандартное состояние можно представить как:
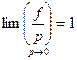 (28)
(28)
Иными словами, летучесть предельно разряженного газа (при р→0) совпадает с его давлением. Летучесть вещества является функцией давления и температуры, причем индивидуальна для каждого конкретного вещества. (Свойство вещества «испаряться» с поверхности.)
Коэффициентом фугитивности или летучести γ называется отношение летучести к давлению:
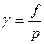 (29)
(29)
и тогда: 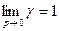 (30)
(30)
Зависимость летучести от давления может быть найдена, если продифференцировать по давлению и по температуре выражение:
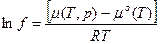 (31)
(31)
где μ – химический потенциал реального газа, μо – стандартный химический потенциал, равный химическому потенциалу гипотетического идеального газа при единичном давлении.
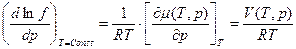 (32)
(32)
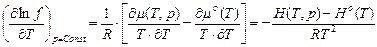 (33)
(33)
Для того чтобы найти 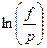 надо взять интеграл от выражений (32 и 33):
надо взять интеграл от выражений (32 и 33):
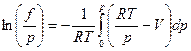 (34)
(34)
Теперь рассмотрим графические методы определения летучести по экспериментальным данным по объему газа при различных величинах давления и постоянной температуре (рис.1).
● построение V – p изотерм (изотермы – зависимости, регистрируемые при постоянной температуре процесса) для рассматриваемого идеального газа;
графическое определение интеграла 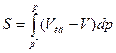 , где нижнее давление такое достаточно малое, что изотермы реального и идеального газов при давлении р* практически сливаются.
, где нижнее давление такое достаточно малое, что изотермы реального и идеального газов при давлении р* практически сливаются.
 |
Рис.1 Диаграммы состояния газа (p - давление, V - объем).
Выражение (34) запишем в виде: 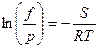 (35)
(35)
где S – площадь между изотермами реального и идеального газов.
При S>0 ((●)), когда Vид> V и pид> p, то отношение (f/p) < 1 и следовательно летучесть f меньше давления: f < p и коэффициент летучести меньше единицы γ < 1 (рис.2). При пересечении изотерм реального и идеального газов может случиться, что S < 0, и тогда отношение (f/p) > 1 и следовательно летучесть окажется больше давления f > p и коэффициент летучести будет больше единицы γ > 1.
● построение зависимости 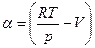 как функцию давления и вычисление площади
как функцию давления и вычисление площади 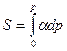 .
.
Выражение (34) примет вид:
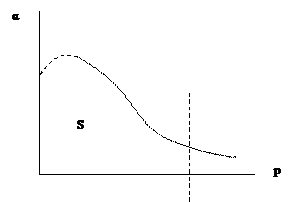
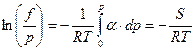
Рис.2 Зависимость α(р).
Преимущество этого способа в том, что при давлении, равном нулю 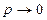
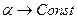 . В этом случае экспериментально найденную зависимость можно экстраполировать на значение давления, равное нулю (р=0).
. В этом случае экспериментально найденную зависимость можно экстраполировать на значение давления, равное нулю (р=0).
Аналитические методы расчета летучести связаны с подстановкой в формулу (34) зависимостей давления при постоянном объеме или объема при постоянном давлении, вытекающих из уравнения состояния идеального газа: 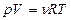 .
.
Для модели газа, рассматриваемого как совокупность твердых притягивающихся сферических частиц (газ Ван-дер-Ваальса) можно записать:
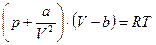 (36)
(36)
где (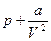 ) представляет собой давление, а (
) представляет собой давление, а (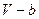 ) представляет собой объем.
) представляет собой объем.
Уравнение Ван-дер-Ваальса является двухпараметрическим, показывающим непрерывность перехода от жидкого к газообразному состоянию и наличие критической точки.
Проинтегрировав уравнение (34) получим:
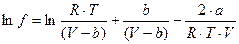 (37)
(37)
Вириальное уравнение состояния записывается как разложение фактора сжимаемости 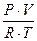 по степеням молярного объема:
по степеням молярного объема:
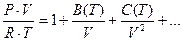
 (38)
(38)
где B(T), C(T) – второй, третий и т.д. вириальные коэффициенты; первый вириальный коэффициент, относящийся к слагаемому с объемом в нулевой степени, равен единице.
Вириальное разложение по степеням давления имеет вид:
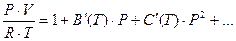 (39)
(39)
Где 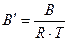
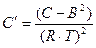 .
.
При невысоких плотностях газа параметр 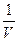 мал и уравнение (38) быстро сходится. В области давления до нескольких десятых Мпа можно ограничиться лишь членом со вторым вириальным коэффициентом:
мал и уравнение (38) быстро сходится. В области давления до нескольких десятых Мпа можно ограничиться лишь членом со вторым вириальным коэффициентом:
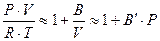 (40)
(40)
При низких температурах B<0, при высоких – B>0, температура, при которой коэффициент В = 0, называется точкой Бойля. В настоящее время имеются теоретические выражения для вириальных коэффициентов, полуэмпирические формулы, связывающие вторые вириальные коэффициенты с физическими константами веществ.
Вириальные уравнения являются удобным способом представления зависимости «давление - объем» при заданной температуре. Вириальные коэффициенты показывают зависимость давления и объема реального газа от характера взаимодействия его частиц.
Выражение (40) можно переписать следующим образом:
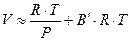
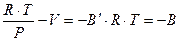 (41)
(41)
Тогда:
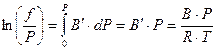 (42)
(42)
Следовательно:
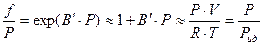 (43)
(43)
или: 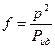 (44)
(44)
Коэффициент летучести γ высчитывается по выражению:
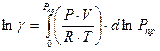 (45)
(45)
где Рпр – приведенное давление 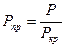 .
.
Критическая точка - точка, в которой жидкость и газообразная фаза становятся идентичными, т.е. их плотности становятся равными.
Коэффициент летучести γ является универсальной функцией приведенных давления и температуры вследствие универсальности зависимости 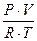 . Использование зависимости относительной летучести α от состава жидкости обусловлено чувствительностью α к наличию случайных погрешностей.
. Использование зависимости относительной летучести α от состава жидкости обусловлено чувствительностью α к наличию случайных погрешностей.
Экспериментальное определение составов сосуществующих жидкости и пара, температур кипения или давления насыщенных паров трудоемко и, иногда возможны, значительные погрешности. Зависимостью α от состава наряду с некоторыми другими методами, пользуются для качественной проверки и выявления погрешностей данных о фазовых равновесиях.
 2015-01-21
2015-01-21 707
707








