Для лучшего понимания рассмотрим конкретный пример:
CuO + SO3 → CuSO4 + 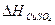 -∆HCuO -
-∆HCuO - 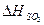
Суммарный тепловой эффект реакции ∆Hx определяется по формуле:
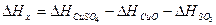
Если известны теплоты образования реагирующих соединений и продуктов реакции, то можно определить и ∆Hx.
Уравнение Кирхгоффа 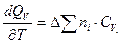 (70)
(70)
показывает изменение теплового эффекта реакции в зависимости от изменения температуры при постоянном объеме, где 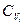 -теплоемкость вещества при постоянном объеме.
-теплоемкость вещества при постоянном объеме.
Для реакции типа n1A + n2B = n3D уравнение (70) можно записать следующим образом:
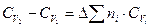
Для случая постоянства давления в системе имеем следующую зависимость:
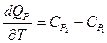 (71)
(71)
и 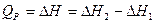
Существует связь между тепловым эффектом при постоянном давлении и тепловым эффектом при постоянном объеме:
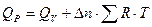 (72)
(72)
И тогда изменение энтропии при изменении температуры, давления или объема можно рассчитать по следующим формулам:
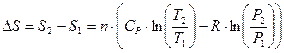 (73)
(73)
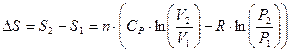 (73)
(73)
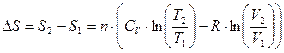 (73)
(73)
Все три уравнения равноправны. В случае T=Const:
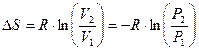 (74)
(74)
В случае P=Const: 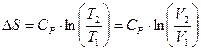 (75)
(75)
В случае V=Const: 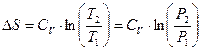 (76)
(76)
Изменение энтропии реальных веществ при нагревании при постоянном давлении для одного моля газа выражается зависимостью:
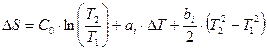 (77)
(77)
Для реальных веществ значения мольных теплоемкостей при постоянном давлении задаются эмпирическим рядом:
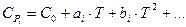 (78)
(78)
Теплопередачу при постоянном давлении и энтропию можно определить как:
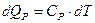
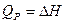
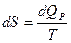
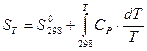 (79)
(79)
и тогда для расчета энтропии и энтальпии химической реакции получим выражения:
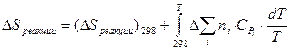 (80)
(80)
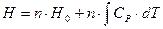 (81)
(81)
С учетом всех вышеприведенных формул получаем итоговое выражение для расчета энергии Гиббса:
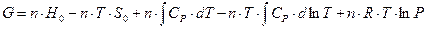 (82)
(82)
Альтернативный вариант определение термодинамического потенциала - рассчитать по отдельности каждую функцию.
Методы определения порядка реакции
1- Метод подстановки основан на определении убыли вещества к нескольким моментам времени. Далее полученные значения изменения концентрации и соответствующих времен подставляются в уравнения разных порядков и анализируются результаты расчетов. Выбирается тот порядок реакции, при подстановки которого в выражения для расчета текущих концентраций наблюдается наилучшее постоянство констант.
2- Метод Вант-Гоффа (метод начальных концентраций).
Рассмотрим некоторую реакцию вида:
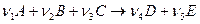 (83)
(83)
В этом случае скорость изменения компонента А определяется как:
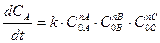 (84)
(84)
или
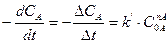 (85)
(85)
где 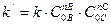
В случае, когда ∆t →0 изменение концентрации вещества А -∆СА можно считать постоянным и тогда получаем следующее выражение:
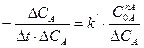 или
или 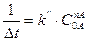 (86)
(86)
где 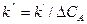
Прологарифмируем выражение (86):
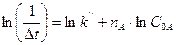 (87)
(87)
В результате получили линейную зависимость ln(1/∆t) от lnC0A. В этом случае порядок реакции можно определить по углу наклона получившейся прямой:
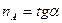 (88)
(88)
Для определения порядка реакции n в целом, а не по компоненту 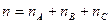 необходимо в уравнении (85) произвести замену:
необходимо в уравнении (85) произвести замену:
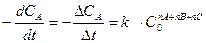 (89)
(89)
и перейти к одной общей начальной концентрации:
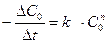 (90)
(90)
Прологарифмируем выражение (90) и получим следующую линейную зависимость:
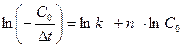 (91)
(91)
По углу наклона зависимости (91) находим константу скорости реакции:
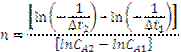
Константа скорости определяется по отрезку, отсекаемому прямой на оси ординат – при равенстве нулю ln(C) отрезок на оси ординат равен ln(k), тогда константа скорости будет рассчитана как:
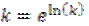

Рис. 4 Полулогарифмическая зависимость Ln(1/∆t) от lnCA
3- Метод изолирования (Оствальда)
Метод аналогичен методу Вант-Гоффа, но определяется частный порядок nA как тангенс угла наклона зависимости:
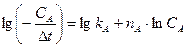 (92)
(92)
Определив все частные порядки реакции, можно определить суммарный порядок реакции:
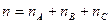
4- По времени полупревращения
Метод основан на экспериментальном измерении времени полупревращения веществ, участвующих в химической реакции. Порядок реакции в этом случае вычисляется по следующей формуле:
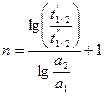 (93)
(93)
где t1/2’ – время полупревращения количества вещества, равного а1 ;
t1/2’’ – время полупревращения количества вещества, равного а2 ;
а1 – некоторое количество одного вещества;
а2 – некоторое количество другого вещества;
 2015-01-21
2015-01-21 796
796








