1. Поверхностное натяжение ПАВ всегда меньше поверхностного натяжения растворителя (иначе накопление вещества в поверхностном слое термодинамически невыгодно).
2. Ограниченная растворимость в воде.
3. Основное свойство, связанное с особенностью строения молекул ПАВ – дифильность. Дифильность охарактеризована Гартли как "раздвоение личности". Молекула ПАВ включает два фрагмента: 1) гидрофильный (полярный), обладающий значительным дипольным моментом, например, группы –СООН, –ОН, –NH2, –CN, –SH, –COH, –NO и др., и 2) гидрофобный (неполярный), обладающий слабым молекулярно-силовым полем – это углеводородный радикал.
При адсорбции полярные группы, условно обозначенные ○, обладающие большим сродством к воде (полярной фазе), втягиваются в нее, а неполярные группы, обозначенные ¾, распределяются в неполярной фазе (воздух, неполярная жидкость), образуя поверхностный слой.
При малых концентрациях ПАВ в растворе их молекулы произвольно ориентируются в поверхностной фазе (рис. 7, а). С увеличением концентрации поверхностный слой заполняется молекулами ПАВ, образующими мономолекулярный адсорбционный слой с плотнейшей упаковкой, соответствующей строгой пространственной ориентации молекул ПАВ (частокол Ленгмюра, рис. 7, б).
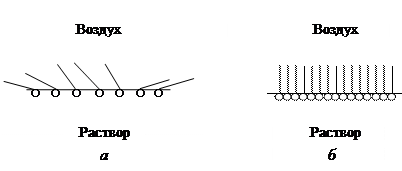 |
Рис. 7. Ориентация молекул ПАВ в поверхностном слое:
а – ненасыщенном, б – насыщенном
Предельная адсорбция достигается при насыщении поверхностного слоя молекулами ПАВ. При дальнейшем повышении концентрации ПАВ в растворе строение адсорбционного слоя, а также поверхностное натяжение раствора больше не изменяются.
Зависимость поверхностного натяжения раствора от концентрации ПАВ описывается уравнением Шишковского
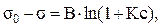 ()
()
где s0, s – поверхностное натяжение растворителя и раствора соответственно; В, К – константы (коэффициент В постоянен для членов одного гомологического ряда).
Из рис. 6 видно, что для ПАВ 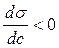 . При малых концентрациях ПАВ характерно резкое снижение s раствора. По мере роста концентрации график становится более пологим и, наконец, переходит в горизонтальную прямую, когда s достигает своего минимального значения.
. При малых концентрациях ПАВ характерно резкое снижение s раствора. По мере роста концентрации график становится более пологим и, наконец, переходит в горизонтальную прямую, когда s достигает своего минимального значения.
Значение производной 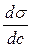 непостоянно и зависит от концентрации вещества. Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при c ® 0). Эту величину П.А. Ребиндер назвал поверхностной активностью g
непостоянно и зависит от концентрации вещества. Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при c ® 0). Эту величину П.А. Ребиндер назвал поверхностной активностью g
 ,
, 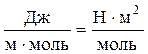
Поверхностная активность – количественная характеристика влияния ПАВ на s. Поверхностная активность – положительная величина, поэтому перед производной стоит знак "–".
 Графически значение g может быть определено как тангенс угла наклона касательной к изотерме поверхностного натяжения в точке, которая соответствует s чистого растворителя (рис. 8).
Графически значение g может быть определено как тангенс угла наклона касательной к изотерме поверхностного натяжения в точке, которая соответствует s чистого растворителя (рис. 8).
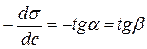 .
.
Поверхностная активность зависит от природы растворенного вещества и растворителя. Для водных растворов поверхностная активность возрастает с уменьшением полярности молекул ПАВ. Так, у органических кислот она больше, чем у их солей. С увеличением в молекуле числа полярных групп g уменьшается.
Увеличение числа неполярных групп в молекуле ПАВ вызывает рост поверхностной активности. Экспериментально установлено, что поверхностная активность возрастает в гомологическом ряду в 3 – 3,5 раза при удлинении углеводородной цепи на одну группу –СН2 (правило Дюкло – Траубе)
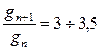 .
.
Так, в гомологическом ряду спиртов поверхностная активность бутанола С4Н9ОН выше, чем пропанола С3Н7ОН и этанола С2Н5ОН.
Правило Дюкло-Траубе действует в рамках одного гомологического ряда.
Более универсальный способ оценки поверхностной активности – вычисление гидрофильно-липофильного баланса (ГЛБ), отражающего сбалансированность гидрофильных и гидрофобных свойств молекул ПАВ
ГЛБ = 7 + S В i,
где В i – групповое число.
Данный метод разработан косметологом Гриффином. Молекулу ПАВ Гриффин рассматривал состоящую из отдельных групп. Каждой группе он придал свой вес – групповое число. Значения ГЛБ определяют сложением групповых чисел В i всех групп, составляющих молекулу ПАВ. Чем выше полярность группы, тем больше ее групповое число. Например, В i группы
–СООК составляет 21,1, –СООН – 2,1, –ОН – 1,9. Групповые числа гидрофобных (неполярных) групп имеют отрицательные значения. В частности, В i групп –СН3, =СН2, =СН– составляет –0,475. Для проявления поверхностно-активных свойств нужно, чтобы оба фрагмента молекулы были достаточно ярко выражены: чем ближе ГЛБ к 7, тем лучше сбалансировано действие полярной и неполярной групп, тем большей поверхностной активностью обладает вещество.
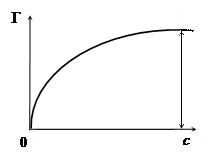
Графическая зависимость величины адсорбции от концентрации при постоянной температуре – изотерма адсорбции (рис. 9).
Максимальное (предельное) значение адсорбции Гmax достигается при насыщении поверхностного слоя молекулами ПАВ.
  | |||
| |||
 2015-02-27
2015-02-27 5032
5032








