Теоретическую основу современной химии составляет атомно-молекулярное учение.
Атом – это наименьшая, химически неделимая частица химического элемента. Нейтральный атом состоит из положительно заряженного ядра и соответствующего этому заряду числа электронов. В нейтральном атоме число протонов в ядре равно числу электронов, движущихся вокруг ядра.
Химический элемент – вид атомов с одинаковым зарядом ядра.
Атомы химических элементов могут соединяться друг с другом, образуя простые, состоящие из одинаковых атомов (О2, Н2, Р4, C и другие), или сложные, состоящие из атомов различных химических элементов, вещества (H2SO4, C12H22O11, NaOH ). Сложные вещества называют химическими соединениями. Для многих химических соединений справедлив закон постоянства состава вещества (Ж.Л. Пруст, 1808 г.) – любое вещество молекулярного строения имеет постоянный качественный и количественный состав независимо от способа его получения.
Молекула – наименьшая частица вещества, сохраняющая его состав и основные химические свойства.
Ионы – электрически заряженные частицы, образующиеся из атомов (или групп атомов) в результате присоединения или потери определенного числа электронов. Катионы – положительно заряженные ионы, анионы – отрицательно заряженные ионы.
| Атом | Ион | Уравнение процесса |
| Na0 | Na+ – катион | Na0 – 1ē = Na+ |
| S0 | S2– – анион | S0 + 2ē = S2– |
Химическая формула – символическая запись состава и простейшего численного соотношения атомов различных элементов, которые образуют химическое соединение. Качественный состав вещества обозначается символами химических элементов, количественный состав – нижними индексами у символов химических элементов, которые показывают число атомов данного элемента в соединении; если в соединение входит один атом элемента, то индекс «единица» не записывают. Например, в состав молекулы серной кислоты H2SO4 входят 2 атома водорода (H2 индекс 2), 1 атом серы (S1 не пишется) и 4 атома кислорода (O4).
Химические явления, или химические реакции, – это явления, при которых одни вещества переходят в другие, отличающиеся от исходных веществ своими свойствами; элементный состав вещества при этом не изменяется.
Закон сохранения массы (М.В. Ломоносов, 1748 г.) – масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Абсолютная масса атома или молекулы выражается в граммах, килограммах или атомных единицах массы. Например,
m (H) = 1,674×10–24 г = 1,674×10–27 кг = 1 а.е.м.
Атомная единица массы (1 а.е.м.) равна 1/12 части массы атома изотопа углерода 12C.
1 а.е.м. = 1/12 m (12С) ≈ 1,66×10–24 г ≈ 1,66·10–27 кг.
Относительная атомная масса элемента (Ar) равна отношению средней массы, приходящейся на атом в природной смеси изотопов, к 1/12 части массы изотопа углерода 12С. Относительнаяатомная масса – безразмерная величина, Ar (Cl) = 35,453; Ar (O) = 15,9994; Ar (S) = 32,0660.
Относительная молекулярная масса (Mr) равна отношению средней массы, соответствующей химической формуле вещества, найденной с учетом состава природной смеси изотопов химических элементов, к 1/12 массы атома изотопа 12C, то есть к 1 а.е.м. Следовательно, относительная молекулярная масса равна сумме относительных атомных масс всех элементов, входящих в состав химического соединения. Для химических расчетов значения Ar и Mr часто округляют до целых чисел, за исключением некоторых случаев, например хлора (35,5). Например, Mr (H2SO4) = 1∙2 + 32∙1 + 16∙4 = 98.
Моль – количество вещества (n, n), содержащее столько же частиц вещества (атомов, молекул, ионов, электронов …), сколько содержится атомов в 0,012 кг изотопа углерода 12С.
Постоянная Авогадро (NA ≈ 6,02×1023 моль-1) – число структурных единиц в одном моле любого вещества.
Молярная масса – масса одного моля вещества. Единица измерения – г/моль; кг/кмоль; мг/ммоль.
Количество вещества n («число молей») можно определить по массе или по количеству структурных единиц:
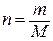 или
или 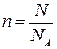 ,
,
где m – масса вещества, M – молярная масса вещества, N – число структурных единиц, NA – число Авогадро.
Закон Авогадро – в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Первое следствие из закона Авогадро – один моль любого газа при одинаковых условиях занимает одинаковый объем.
При нормальных условиях (н.у.): T = 273,15 K (t = 0 ˚C) и P = 101 325 Па (1 атм = 760 мм ртутного столба) 1 моль идеального газа занимает объем 22,4 л. Мольные объемы реальных газов при нормальных условиях очень близки к этой величине.
Количество газообразного вещества n газ находится по формуле
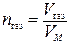 ,
,
где V газ – объем газа; VM – мольный объем газа (VM = 22,4 л/моль при н.у.).
Уравнение Клапейрона – Менделеева:
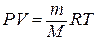 ,
,
где P – давление газа, V – объем газа, m – масса газа, M – молярная масса газа, R – универсальная газовая постоянная, R = 8,314 Дж/(моль×К).
Валентность – способность атома химического элемента образовывать определенное количество химических связей с атомами других химических элементов.
Электролиты – вещества, водные растворы или расплавы которых проводят электрический ток; к электролитам относятся кислоты, основания, соли.
Неэлектролиты – вещества, растворы или расплавы которых не проводят электрический ток.
Электролитическая диссоциация – распад электролита на ионы при растворении или плавлении. Диссоциация – обратимый процесс; обратный процесс называется ассоциацией.
Кислота – электролит, при диссоциации которого образуются только катионы водорода H+ и анионы кислотного остатка.
НСl Á H+ + Cl–
Многоосновные кислоты – кислоты, в состав которых входят несколько атомов водорода; многоосновные кислоты диссоциируют ступенчато:
H2SO4 Á H+ + HSO4– (1-я ступень);
HSO4– Á H+ + SO42– (2-я ступень);
H2SO4 Á 2H+ + SO42– (суммарное уравнение диссоциации).
Диссоциация многоосновных кислот преимущественно протекает по первой ступени.
Основание – электролит, при диссоциации которого образуются только гидроксид-анионы OH– и катионы металла или аммония.
NaOH Á Na+ + OH–
Многокислотные основания – основания, в состав которых входит несколько гидроксид-анионов OH– , они диссоциируют ступенчато:
Al(OH)3 Á Al(OH)2+ + OH– (1-я ступень);
Al(OH)2+ Á AlOH2+ + OH– (2-я ступень);
AlOH2+ Á Al3+ + OH– (3-я ступень);
Al(OH)3 Á Al3+ + 3OH– (суммарное уравнение диссоциации).
Диссоциация многокислотных оснований преимущественно протекает по первой ступени.
Средняя соль – электролит, при диссоциации которого образуется катион металла или аммония и анион кислотного остатка:
NH4Cl Á NH4 + + Cl–
K2SO4 Á 2K+ + SO42–.
Кислая соль – электролит, при диссоциации которого образуются катион металла и анион кислотного остатка, содержащий атом водорода. Анион кислотного остатка участвует в процессе вторичной диссоциации:
NaHSO3 Á Na+ + HSO3–
HSO3– Á H+ + SO32–
Оснόвная соль – электролит, при диссоциации образуются катион, состоящий из металла и гидроксогрупп, и анион кислотного остатка. Гидроксокатион металла также способен к диссоциации:
СaОHСl Á CaOH+ + Cl–
CaOH+ Á Ca2+ + OH–
Оксиды – сложные вещества, состоящие из двух элементов, один из которых атом кислорода в степени окисления –2. Оксиды относятся к неэлектролитам и в растворах не диссоциируют.
 2015-02-27
2015-02-27 580
580








