1Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
2 Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество:
AgNO3 + HBr = AgBr¯ + HNO3
FeS + 2HCl = FeCl2 + H2S↑
3 Взаимодействие растворимой соли с растворимым основанием, в результате которого образуется нерастворимое соединение:
CuCl2 + 2KOH = Cu(OH)2¯ + 2KCl
K2CO3 + Ba(OH)2 = BaCO3↓ + 2KOH
4 Взаимодействие растворимых солей друг с другом, в результате которого образуется нерастворимое соединение:
Na2CO3 + Ca(NO3)2 = CaCO3¯ + 2NaNO3
5 Разложение солей при нагревании:
Fe2(SO4)3 = Fe2O3 + 3SO3
2NaNO3 = 2NaNO2 + O2↑
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
6 Гидролиз некоторых солей:
(NH4)2CO3 + H2O = 2NH4OH + CO2
MgCl2 + H2O = MgOHCl + HCl
Na2CO3 + H2O = NaHCO3 + NaOH
7 Участие в ОВР по кислотному остатку:
2KBr + Cl2 = 2KCl + Br2
2NaNO2 + O2 = 2NaNO3
Na2SO3 + H2O + Cl2 = Na2SO4 + 2HCl
Степенью окисления называется условный заряд на атоме химического элемента, вычисленный исходя из предположения, что все его связи с соседними атомами – ионные, то есть электронные пары полностью смещены в сторону атомов с большей электроотрицательностью.
Атомы химических элементов могут иметь различные степени окисления в зависимости от того, в состав каких веществ они входят. В любом простом веществе степень окисления его атомов равна нулю. В соединениях элементы главных подгрупп 1-й и 2-й групп имеют степени окисления +1 и +2 соответственно, алюминий всегда имеет степень окисления +3, цинк +2, фтор –1, кислород –2 (за исключением пероксидов и F2O), водород +1 (за исключением гидридов металлов). Максимальная положительная степень окисления равна номеру группы, в которой находится элемент в периодической системе; наименьшая отрицательная степень окисления (в названиях бинарных соединений это отражается суффиксом –ИД равна (8 – номер группы). В тех случаях, когда степень окисления элемента может иметь разные значения в различных соединениях, ее вычисляют исходя из требования: сумма положительных зарядов в молекуле должна быть равна сумме отрицательных зарядов в молекуле, то есть молекула должна быть электронейтральной. Как составлять уравнение электронейтральности и вычислять степень окисления, понять нетрудно, если внимательно разобраться в приводимых примерах.
| а) | 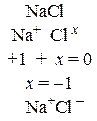
| б) | 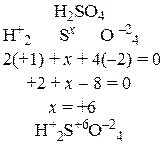
| в) | 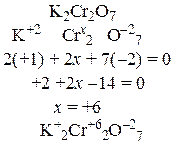
|
По известным значениям степеней окисления составляют формулы химических соединений. Для этого записывают значения степеней окисления отдельных элементов и подбирают индексы таким образом, чтобы молекула оставалась электронейтральной; в формулах неорганических соединений индексы должны быть по возможности наименьшими.
Пример 1. Составить формулы оксида алюминия, фосфида алюминия и сульфата железа (III).
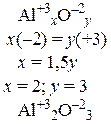
| 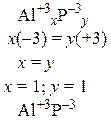
| 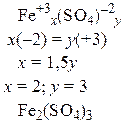
|
Пример 2. Составьте ионно-молекулярные уравнения реакции взаимодействия в растворах: а) AgNO3 и K2CrO4; б) NaOH и H2SO4; в) CaCO3 и HCl. Укажите признаки необратимости этих реакций. К какому типу реакций они относятся?
 2015-02-27
2015-02-27 701
701








