Вначале запишем электронные конфигурации атомов бора и фтора:
5B [He] 2 s 22 p 1 и 9F [He] 2 s 22 p 5.
Электронные структуры валентных орбиталей этих атомов имеют вид:
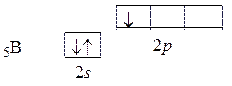
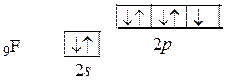
Центральным атомом является атом бора. В возбужденном состоянии электрон с 2 s -подуровня промотирует в свободную энергетическую ячейку 2 p -подуровня и в соответствии с правилом Гунда занимает свободную орбиталь.
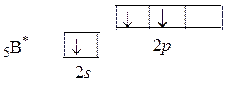
Понятно, что валентность по обменному механизму Bобм = 3 (атом имеет 3 неспаренных электрона), по донорно-акцепторному – Bд-а = 1. При этом в образовании химических связей участвуют орбитали с различными типами симметрии (s и p). Поэтому происходит их гибридизация с образованием гибридных q -орбиталей:
s + p  ® (sp
® (sp 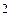 ) ® q
) ® q 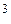 .
.
Форма гибридной орбитали:

Оси трех гибридных орбиталей ориентированы к вершинам равностороннего треугольника так, чтобы отталкивание электронов на этих орбиталях было минимальным. Эти орбитали перекрываются с p -орбиталями атома фтора, образуя три s-связи:
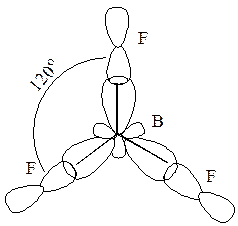
Из электронной структуры атома В видно, что еще одна p -орбиталь может быть использована для образования донорно-акцепторной связи. Она ориентирована перпендикулярно плоскости, в которой находятся s-связи. Донорами электронных пар могут три равноценных атома фтора. При этом образуется p-связь с равномерно распределенной электронной плоскостью между атомами:
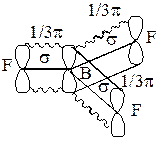
Это дополнительная, четвертая связь (p-связь) распределена между тремя атомами фтора. Она делокализована:
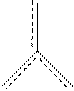 F
F
B
F F
Надо заметить, что p -орбиталь, не участвуя в гибридизации, стабилизирует общую связь между атомами. За счет p-связи кратность связи повышается, что приводит к уменьшению длины связей B–F.
У иона BF–4 ориентация атомов фтора отличается от рассмотренной в молекуле BF3. Ион F– имеет четыре электронные пары, одна из которых может перейти на свободную орбиталь атома В и образовать ковалентную связь по донорно-акцепторному механизму. Поскольку разность энергий двух подуровней в атоме бора сравнительно мала (∆ E2s–2p = 5,7 эВ) и атом бора имеет малый орбитальный радиус (0,077 нм), то все четыре орбитали в атоме бора подвергаются sp3- гибридизации:
s + p 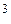 → (sp
→ (sp 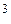 ) → q
) → q 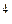 .
.
Взаимная ориентация осей гибридных орбиталей – тетраэдрическая. Образующиеся s-связи неупрочнены p-связями, следовательно, длина связи B–F в ионе BF–4 больше, чем в молекуле BF 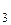 .
.
Пример 3. Изобразите схему перекрытия орбиталей в молекуле CO 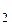 , учитывая, что она имеет линейную форму.
, учитывая, что она имеет линейную форму.
 2015-02-27
2015-02-27 1626
1626








