Валентность углерода в молекуле CO 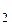 равна четырем. Это означает, что четыре электрона атома углерода принимают участие в образовании связей. Изобразим электронную структуру атома в возбужденном состоянии:
равна четырем. Это означает, что четыре электрона атома углерода принимают участие в образовании связей. Изобразим электронную структуру атома в возбужденном состоянии:
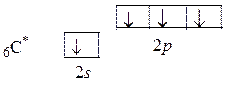
Поскольку молекула линейна, в атоме С осуществляется sp -гибридизация, характерная для таких молекул. При этом только одна из трех p -орбиталей участвует в гибридизации, а две остаются негибридизированными:
s + p 3 ® (sp) p 2 → q 2 p 2.
Эти четыре орбитали ориентированы так, чтобы отталкивание между ними было минимальным: две q -орбитали ориентированы по линии связи (угол между их осями составляет 180°), а две p -орбитали расположены взаимно перпендикулярно, и угол между их осями и линией связи составляет 90°. Эта взаимная ориентация представлена на схеме:
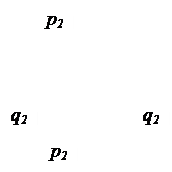

Теперь изобразим электронную структуру атома кислорода:
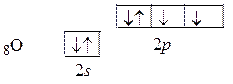
У атома кислорода имеются две р -орбитали, содержащие неспаренные электроны. Эти орбитали расположены под углом 90°. Одна из них участвует в s-связывании с q -орбиталями атома углерода, а вторая образует p-связь с р -орбиталью атома углерода. При этом p-связывание двух атомов кислорода осуществляется с двумя взаимно перпендикулярными р -орбиталями атома С. Изобразим p-связывание волнистой линией. Тогда схема перекрытия орбиталей имеет вид:

Третьим основным свойством химической связи является поляризуемость. Она характеризует смещение электронного облака в сторону более электроотрицательного атома, участвующего в образовании связи. Причиной такого смещения является различие силовых полей взаимодействующих атомов, которое оценивается по величинам электроотрицательностей атомов (ЭО).
Если взаимодействующие атомы вносят одинаковый вклад в межъядерное поле, то образуемая связь является неполярной. Такая связь возникает при взаимодействии одинаковых атомов. В остальных случаях связь носит полярный характер. Атомы приобретают эффективный заряд ± q, и возникает электрическая асимметрия, характеризуемая дипольным моментом
m = qL.
где m – дипольный момент молекулы; L – длина диполя. В физике вектор дипольного момента направлен от отрицательного заряда к положительному. Химики часто применяют противоположное направление, которое указывает, куда смещается электронная плотность при образовании связи. Размерность дипольного момента – Кл×м. Величина L, как правило,меньше расстояния между ядрами атомов d.
Дипольный момент всей молекулы является векторной суммой дипольных моментов отдельных связей. При сильной поляризации связь превращается в ионную. Ионная связь образуется при полном переходе электрона от одного атома к другому. Практически связь считают ионной, если разность ЭО > 1,9. Надо понимать, что и в этом случае связь является частично ковалентной. При полном смещении электронной пары к одному из атомов длина диполя L становится равной расстоянию между атомами. Степень диполярности (ионность) связи оценивается величиной:
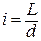 .
.
Очевидно, что 0 ≤ i < 1. Ионность связи выражается в процентах или долях от единицы. Она характеризует эффективный заряд атома.
Следует отметить, что не все электроны на внешних орбиталях атома обязательно участвуют в образовании связей. Например, у атома азота из пяти внешних электронов при образовании молекулы аммиака три электрона образуют s-связи, а два остаются несвязывающими (неподелённая электронная пара):
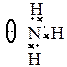
Несвязывающие электроны вызывают отталкивание q -орбиталей, изменяют валентные углы и существенно влияют на электрическую асимметрию молекул. Поэтому при рассмотрении строения молекул необходимо учитывать наличие таких электронов [4].
Пример 4. На основании электронного строения молекул провести сравнительный анализ основных характеристик связей и их полярности по данным таблицы.
| Молекула | Межъядерное расстояние, нм | Валентный угол, град. | Дипольный момент, m ×10 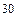 Кл×м Кл×м |
NH 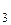 | d 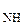 = 0,102 = 0,102 | 4,95 | |
NF 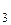 | d 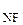 = 0,137 = 0,137 | 102,4 | 0,66 |
PH 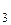 | d 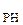 = 0,142 = 0,142 | 93,5 | 1,97 |
PF 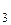 | d  = 0,155 = 0,155 | 3,50 |
 2015-02-27
2015-02-27 1428
1428
