Прежде всего определим форму рассматриваемых молекул. Запишем электронные конфигурации атомов N, P, H, F.
N … 2 s 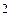 2 p
2 p 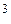 ; P … 3 s
; P … 3 s 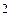 3 p
3 p 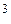 ; H … 1 s
; H … 1 s 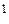 ; F … 2 s
; F … 2 s 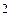 2 p
2 p 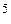 .
.
Центральными атомами в молекулах являются N и P. Запишем схемы распределения электронов для этих атомов:
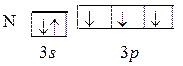
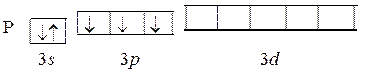
Общее число орбиталей каждого из этих атомов, участвующих в
образовании связей, N  = 4. В обоих случаях происходит
= 4. В обоих случаях происходит
sp3 -гибридизация, а форма молекул – пирамидальная, с четырьмя вершинами.
Проанализируем теперь электронное строение атомов-заместителей:
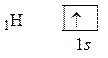 | 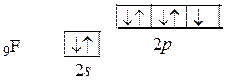 |
Очевидно, что эти атомы способны образовывать по одной s-связи с центральным атомом. Кроме того, атом F может участвовать и в образовании донорно-акцепторной связи.
Рассматриваемые атомы резко отличаются по электроотрицательностям. Так как ЭО 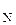 = 3,0 > ЭО
= 3,0 > ЭО 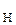 = 2,1, то дипольный момент связей в молекуле NH
= 2,1, то дипольный момент связей в молекуле NH 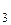 направлен к менее электроотрицательным атомам H. Следовательно, эта молекула обладает значительным дипольным моментом.
направлен к менее электроотрицательным атомам H. Следовательно, эта молекула обладает значительным дипольным моментом.

В молекуле NF 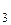 дело обстоит иначе. Так как ЭО
дело обстоит иначе. Так как ЭО 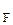 = 4,0 > ЭО
= 4,0 > ЭО 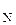 = 3,0, то дипольные моменты связей направлены от F к N. В этом случае векторная сумма, т.е. дипольный момент молекулы, намного меньше, чем у NH
= 3,0, то дипольные моменты связей направлены от F к N. В этом случае векторная сумма, т.е. дипольный момент молекулы, намного меньше, чем у NH 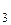 .
.
|
|
|
Сопоставим теперь валентные углы в молекулах NH 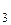 и PH
и PH 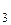 . Как видно из вышеприведенной таблицы, валентный угол HPH приближается к прямому. Этот факт можно обьяснить уменьшением гибридизации, поскольку 3 s - и 3 p -орбитали имеют бóльшие размеры в сравнении с 2 s - и 2 p -орбиталями. Об этом говорят и величины межъядерных расстояний в молекулах.
. Как видно из вышеприведенной таблицы, валентный угол HPH приближается к прямому. Этот факт можно обьяснить уменьшением гибридизации, поскольку 3 s - и 3 p -орбитали имеют бóльшие размеры в сравнении с 2 s - и 2 p -орбиталями. Об этом говорят и величины межъядерных расстояний в молекулах.
Валентный угол в молекуле PF 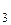 больше, чем в PH
больше, чем в PH 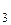 , что можно объяснить донорно-акцепторным взаимодействием d -орбиталей атома фосфора с неподеленными электронными парами атомов фтора (p-связывание). В результате этого связи P–F делокализуются, и валентный угол приближается к тетраэдрическому. При этом неподеленная электронная пара в PF
, что можно объяснить донорно-акцепторным взаимодействием d -орбиталей атома фосфора с неподеленными электронными парами атомов фтора (p-связывание). В результате этого связи P–F делокализуются, и валентный угол приближается к тетраэдрическому. При этом неподеленная электронная пара в PF 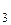 в результате p-связывания уже не вносит свой вклад в векторную сумму и величина дипольного момента молекулы увеличивается в сравнении с NF
в результате p-связывания уже не вносит свой вклад в векторную сумму и величина дипольного момента молекулы увеличивается в сравнении с NF 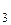 . Поэтому дипольный момент молекулы PF
. Поэтому дипольный момент молекулы PF 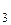 велик. При наличии прямоугольной ориентации дипольных моментов связей в молекуле PH
велик. При наличии прямоугольной ориентации дипольных моментов связей в молекуле PH 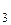 дипольный момент молекулы мал в сравнении с PF
дипольный момент молекулы мал в сравнении с PF 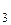 . Неподеленная s -электронная пара молекулы PH
. Неподеленная s -электронная пара молекулы PH 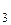 в силу симметрии s -орбитали не оказывает влияния на дипольный момент молекулы.
в силу симметрии s -орбитали не оказывает влияния на дипольный момент молекулы.
Задачи
131 Допуская, что каждый атом вносит постоянный вклад в межатомное расстояние, вычислите его для молекул HF, HCl, HBr и HI, если d F–F = 0,142; d Cl–Cl = 0,199; d Br–Br = 0,228; d I–I = 0,267 и d H–H = 0,074 нм.
Ответ: 0,108; 0,136; 0,151; 0,170 нм.
132 Почему для атома серы характерны четные валентности, а для атома хлора – нечетные? Ответ мотивируйте, построив электронные структуры внешних оболочек этих атомов.
|
|
|
133–134 Энергии ионизации при последовательном отрыве электронов от атома равны соответственно:
133) B – 8,3; 25,15; 37,9; 259,4; 340,2 эВ;
134) N – 14,5; 29,4; 47,4; 77,0; 97,3; 549,0; 663,0 эВ.
Постройте график зависимости энергии ионизации от номера отрываемого электрона. Объясните ход кривой на графике и укажите границу между валентными и внутренними электронами. На основании электронных конфигураций определите высшие и низшие степени окисления атомов.
135–137 Составьте электронные формулы атомов:
135) Al, Mn, Ge; 136) Cl, Cr*, Se; 137) Mg, Cu*, Ga.
На основании электронных структур внешних оболочек этих атомов определите валентность по обменному и донорно-акцепторному механизму. Рассмотрите возбужденные состояния и определите валентность атомов. У атомов, отмеченных звездочкой, наблюдается проскок электрона.
138–140 Изобразите схемы перекрывания атомных орбиталей при образовании s- и p-связей в молекулах:
138) N2 и CH2Cl2; 139) C2H2 и CO2; 140) AlI3 и C2H2.
141–142 Изобразите схемы перекрывания атомных орбиталей в молекулах: 141) H 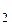 O; 142) NH
O; 142) NH 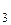 . Валентные углы в рядах гидридов имеют следующее значение:
. Валентные углы в рядах гидридов имеют следующее значение:
141) H2O – H2S – H2Se – H2Te – 104,5 – 93 – 91,5 – 91˚;
142) NH3 – PH2 – AsH3 – SbH3 – 107,3 – 93,3 – 91,8 – 91,3˚.
Чем объясняется уменьшение валентных углов? Почему во всех случаях они больше 90°?
143 Валентные углы в молекулах CH4, NH3 и H2O соответственно равны 109,5˚, 107,8˚ и 104,5˚. Изобразите схемы перекрывания орбиталей и объясните причины уменьшения валентного угла в этом ряду.
144 На основании электронных структур атомов Be, B, N и O определите их валентности по обменному и донорно-акцепторному механизмам в основном и возбужденном состояниях. Возможна ли донорная или акцепторная функция для центрального атома в молекулах BCl3 и NH3?
145–147 По данным табл. 6.1 постройте график зависимости энергии связи от межъядерного расстояния в рядах молекул. Используя табл. 6.2, постройте график зависимости энергии связи от разности электроотрицательностей атомов. На основании полученных данных сформулируйте выводы.
145) LiF, LiCl, LiBr, LiI;
146) HF, HCl, HBr, HI;
147) MgO, CaO, SrO, BaO.
Таблица 6.1
Межъядерные расстояния d (нм) и энергия связи Е св. (кДж/моль)
для некоторых молекул
| Молекула | d | E 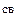 | Молекула | d | E 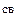 |
| LiF | 0,156 | HF | 0,092 | ||
| LiCl | 0,202 | HCl | 0,127 | ||
| LiBr | 0,217 | HBr | 0,141 | ||
| LiI | 0,239 | HI | 0,161 | ||
| MgO | 0,175 | SrO | 0,192 | ||
| CaO | 0,182 | BaO | 0,194 |
148 Укажите вид химической связи в молекулах Н2, Cl2, НCl. Приведите схему перекрывания электронных облаков.
149 Как изменяется прочность связи в ряду HF, HCl, HBr, HJ? Укажите причины этих изменений. Связь в каком из этих соединений наиболее полярная?
150 Дипольные моменты молекул галогеноводородов равны:
m HF = 1,91×10–29, m HCl = 1,03×10–29, m HBr = 0,79×10–29, m HI = 0,42×10–29 Кл×м. Постройте график зависимости величины дипольного момента от разности электроотрицательностей атомов, входящих в состав молекул (табл. 6.3). Объясните характер этой зависимости.
Таблица 6.2
Относительные электроотрицательности атомов (по Полингу)
| Период | Группа | ||||||
| H 2,1 | |||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | |
| Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 | |
| Cs 0,7 | Ba 0,9 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 |
 2015-02-27
2015-02-27 2499
2499
