При разбавлении концентрированного раствора растворителем (водой) увеличивается масса раствора, но масса растворенного вещества (Н2SO4) остается постоянной и во вновь приготовленном растворе. Следовательно, изменяется отношение масс растворенного вещества и раствора, то есть концентрация.
С учетом равенства массы Н2SO4 в концентрированном и разбавленном растворах используем формулу (7.3):
ω′ m ′ = ω′ (m + m (H2O)) = ω∙ m,
где ω, m – массовая доля, масса концентрированного раствора;
ω′, m ′ – массовая доля, масса разбавленного раствора.
Массу раствора можно выразить через объем раствора и его плотность:
m = V ∙ρ.
С учетом этого соотношения преобразуем формулу (7.6):
ω′ V ′ρ′ = ω V ρ.
Отсюда
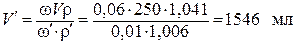 .
.
Для нахождения молярной доли Н2SO4 необходимо вычислить массу (m ′) Н2SO4 и массу Н2О в разбавленном 1,0 %-ном растворе
m ′ = ω′∙ m р-ра = ω′∙ V ′∙ρ′ = 0,01∙154∙1,006 = 15,553 г;
m р-ра = V ′∙ρ′ = 1546∙1,006 = 1555,276 г;
m (H2O) = m р-ра – m ′ = 1555,276 – 15,553 = 1539,723 г;
M (H2SO4) = 2∙1 + 32 + 4∙16 = 98 г/моль; М (Н2О) = 2∙1 + 16 = 18 г/моль.
Определим молярную долю Н2SO4 в растворе (см. табл. 7.1).
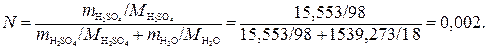
Пример 3. Рассчитать массовую долю (ω′′) серной кислоты в растворе, приготовленном смешением 50 мл разбавленного раствора с молярной концентрацией 1,1 моль/л и плотностью 1,06 г/мл с 10 мл концентрированного раствора с массовой долей Н2SO4 98 % и плотностью 1,9 г/мл.
 2015-02-27
2015-02-27 552
552








