Пример 1. Выразите в граммах массу одной молекулы СО2.
Решение. Молекулярная масса СО2 равна 44,0 а.е.м. Следовательно, молярная масса СО2 равна 44,0 г/моль. 1 моль СО2 содержит 6,02 ∙ 1023 молекул. Отсюда находим массу одной молекулы:
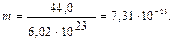
Пример 2. Определите объем, занимаемый 5,25 г азота при 26°С и давлении 98,9 кПа (742 мм рт.ст.).
Решение. Зная молярный объем и молярную массу (28,0 г/моль) азота, находим объем, который будут занимать 5,25 г азота при н.у.:
28,0 г азота занимают объем 22,4 л,
5,25 г - Vo,
откуда 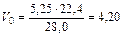 л.
л.
Затем приводим полученный объем к указанным в задаче условиям:
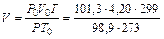 = 4,71 л.
= 4,71 л.
Пример 3. Плотность газа по воздуху равна 1,17. Определите молекулярную массу газа.
Решение. Из закона Авогадро следует, что в одинаковых условиях массы (m) равных объемов газов относятся как их молярные массы (М):
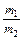 =
= 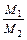 ,
,
где m1 / m2 – относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
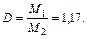
Средняя молярная масса воздуха М2 равна 29,0 г/моль. Тогда
М1 = 1,17 × 29,0 = 33,9 г/моль,
что соответствует молекулярной массе, равной 33,9 а.е.м.
Пример 4. Определите молекулярную массу газа, если при нормальных условиях 0,824 г его занимают объем 0,260 л.
Решение. При нормальных условиях 1 моль любого газа занимает 22,4 л. Вычислив массу 22,4 л данного газа, мы узнаем его молярную массу.
0,824 г газа занимают объем 0,260 л,
х г 22,4 л,
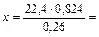 71,0 г.
71,0 г.
Следовательно, молярная масса газа равна 71,0 г/моль, а его молекулярная масса - 71 а.е.м.
Пример 5. Вычислите молекулярную массу бензола, зная, что масса 600 мл ее паров при 87°С и давлении 83,2 кПа равна 1,30 г.
Решение. Выразив данные задачи в единицах СИ (Р = 8,32 ∙ 104 Па, Т = 360 К, V = 6 10-4 м3, m = 1,30 10-3 кг,) и подставив их в уравнение Клапейрона-Менделеева, находим:
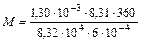 = 78,0 × 10-3 кг/моль =78 г/моль.
= 78,0 × 10-3 кг/моль =78 г/моль.
Молекулярная масса бензола равна 78,0 а.е.м.
Пример 6. Найдите простейшую формулу оксида хрома, содержащего 68,4 мас.%, хрома.
Решение. Обозначим числа атомов хрома и кислорода в простейшей формуле оксида соответственно через х и у. Атомные массы этих элементов равны 52 и 16. Поэтому массы хрома и кислорода в составе оксида относятся как 52 х: 16 у. Следовательно
52 x: 16 y = 68,4: 31,6,
откуда
x: y = 1,32: 1,98.
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них:
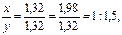
а затем умножим оба члена последнего отношения на два:
x: y = 2: 3
Таким образом, простейшая формула оксида хрома Сr2О3.
Пример 7. При полном сжигании 2,66 г некоторого вещества получилось 1,54 г СO2 и 4,48 г SO2. Найдите простейшую формулу вещества.
Решение. Состав продуктов горения показывает, что вещество содержало углерод и серу. Кроме этих двух элементов, в состав вещества мог входить и кислород. Массу углерода, входившего в состав вещества, находим по массе образовавшегося CO2. Молярная масса СО2 равна 44 г/моль, при этом в 1 моль СО2 содержится 12 г углерода. Находим массу углерода m, содержащуюся в 1,54 г СО2:
44: 12 = 1,54: m;
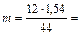 0,42 г.
0,42 г.
Вычисляя аналогичным способом массу серы, содержащуюся в 4,48 г SO2, получаем 2,24 г.
Таким образом, в сгоревшем веществе на 0,42 г углерода приходится 2,24 серы. Так как сумма этих двух масс равна общей массе сгоревшего вещества (2,66 г), то кислорода в нем не содержится.
Вычисляем отношение числа атомов углерода (х) и серы (у) в молекуле сгоревшего вещества:
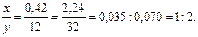
Следовательно, простейшая формула вещества CS2.
Пример 8. Газообразное соединение азота с водородом содержит 12,5. мас. % водорода. Плотность соединения по водороду равна 16. Найдите молекулярную формулу соединения.
Решение. Находим отношение числа атомов азота (х) к числу атомов водорода (у) в молекуле соединения:
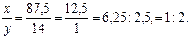
Простейшая формула соединения NH2. Этой формуле отвечает молекулярная масса, равная 16.
Истинную молекулярную массу вещества находим, исходя из его плотности по водороду:
M = 2 × 16 = 32 а.е.м.
Таким образом, истинная молекулярная масса вещества вдвое больше вычисленной по его простейшей формуле. Следовательно, молекулярная формула соединения N2H4.
Пример 9. Найдите массу серной кислоты, необходимую для полной нейтрализации 20 г гидроксида натрия.
Решение. Уравнение протекающей реакции
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Молекулярные массы H2SO4 и NaOH соответственно равны 98 и 40, следовательно, их молярные массы составляют 98 и 40 г/моль.
Согласно уравнению реакции, 1 моль H2SO4 реагирует с 2 моль NaOH, т.е.
98 г H2SO4 нейтрализуют 80 г NaOH
x г H2SO4 ------ ---------- 20 г NaOH
отсюда 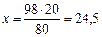 г.
г.
Пример 10. Хлор может быть получен действием серной кислоты на смесь МnО2 с NaCl. Реакция протекает по уравнению
2NaCl + МnО2 + 3H2SО4 = 2NaHSO4 + MnSO4 + Сl2 + 2Н2О
Какой объем хлора (условия нормальные) можно получить из 100 г хлорида натрия?
Решение. Согласно уравнению реакции, из 2 моль NaClполучается 1 моль Сl2. Рассчитав массу 2 моль NaCl (117 г), составляем пропорцию:
117 г NaCl-------- 22,4 л Сl2
100 г NaCl -------- х л Сl2
Следовательно,
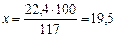 л.
л.
Пример 11. Определите эквивалент и эквивалентные массы серы и хлора в соединениях H2S,HCl.
Решение. Эквиваленты равны соответственно 1/2 моль, 1 моль. Исходя из молярных масс атомов этих элементов, определяем массы эквивалентов:
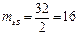 г/моль,
г/моль,
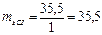 г/моль.
г/моль.
Пример 12. Определите эквивалент и эквивалентную массу ортофосфорной кислоты в следующих уравнениях реакций:
а) NaOH + H3PO4®NaH2PO4 + Н2О,
б) 2NaOH + H3PO4®Na2HPO4 + 2Н2О,
в) 3NaOH + H3PO4®Na3PO4 + 3Н2О.
Решение. Для определения массы эквивалента сложного вещества по уравнению реакции нужно разделить его молярную массу (М) на сумму валентностей замещенных радикалов (H+, OH-, Kt n +, An n -). В реакциях а, б, в эквиваленты H3PO4, равны соответственно 1 моль, 1/2 моль, 1/3 моль; массы эквивалентов:
а) mэ H3PO4 = M /1= М = 98 г/моль,
б) mэ H3PO4 = M /2 = 98/2 = 46 г/моль,
в) mэ H3PO4 = М /3= 98/3 = 33 г/моль.
Пример 13. Определите эквивалентную массу азотной кислоты в реакции
8HNO3 + 3Сu®3Сu(NO3)2 + 2NO + 4H2O
 |
N5+ + 3 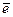 →N2+ 2
→N2+ 2
Сu0 − 2 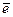 →Сu2+ 3
→Сu2+ 3
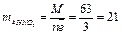 г/моль.
г/моль.
Пример 14. При сгорании 5 г металла образуется 9,44 г оксида металла. Определите эквивалентную массу металла.
Решение. В соответствии с законом эквивалентов
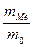 =
= 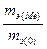 ,
,
m кислорода = m оксида – mM e = 9,44 – 5 = 4,44 (г),
mэ(о) = A / B = 16 / 2 = 8 г/моль,
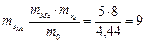 (г/моль).
(г/моль).
Пример 15. Количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определите массу металла.
Решение. Зная, что эквивалентный объем водорода равен 11,2 л/моль, воспользуемся законом эквивалентов:
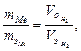
где 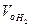 – объем водорода при н.у.;
– объем водорода при н.у.; 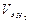 – эквивалентный объем водорода,
– эквивалентный объем водорода,
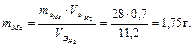
Вопросы для самоподготовки
1. Что называется эквивалентом, молярной массой эквивалента вещества, эквивалентным объемом?
2. Плотность газа по воздуху равна 0,59. Массовая доля азота в нем составляет 82,35%, водорода – 17,65%. Выведите формулу газа.
3. Какой объем займут 1,505 · 1023 молекул газа при н.у.?
4. Какая масса природного известняка, содержащего 90 мас. % CaCO3, потребуется для получения 7,0 т негашеной извести? Какой объем газа выделится (T = 600°C, P = 750 мм.рт.ст.)?
5. Вычислите объем водорода, выделившегося при взаимодействии цинка массой 13 г с серной кислотой массой 30 г (T = 23°C, P = 7 атм.).
6. Молярные массы эквивалентов кислорода и серы равны 8 г/моль. Выведите формулу их соединения и вычислите его молярную массу.
7. При взаимодействии 1,04 г некоторого металла с раствором кислоты выделилось 0,672 дм3 водорода. Определите этот металл.
8. При разложении оксида металла массой 0,92 г выделился металл массой 0,86 г. Вычислите молярную массу эквивалента металла.
9. Определите массу соли, образующейся при взаимодействии оксида кальция массой 14 г с раствором, содержащим азотную кислоту массой 35 г.
10. К раствору, содержащему хлорид кальция массой 0,22 г, прибавили раствор, содержащий нитрат серебра массой 2,00 г. Какова масса образовавшегося осадка? Какие вещества будут находиться в растворе?
11. Определите эквивалентную массу карбоната кальция в реакции: CaCO3 + 2HCI = CaCI2 + CO2 + H2O
ТЕСТЫ
1. У какого из элементов эквивалентная масса равна 8 г/ моль-экв?
а) азот;
б) кислород;
в) углерод;
г) кремний.
2. Что такое абсолютная масса?
а) масса одной структурной единицы (атома, молекулы, иона);
б) число частиц в одном моль;
в) масса сложного соединения;
г) масса простого соединения.
3. В какой реакции эквивалент ортофосфорной кислоты равен единице?
а) H3PO4 + KOH = KH2PO4 + H2O;
б) H3PO4 + 3KOH = K3PO4 + 3H2O;
в) H3PO4 + 2KOH = K2HPO4 + 2H2O.
4. Какой объем занимают 4,4 г оксида углерода (IV) (н,у.)?
а) 11,2 л;
б) 44 л;
в) 2,24 л;
г) 22,4 л;
д) 4,4 л.
5. Какова формула соли, если массы элементов находятся в соотношении K: S: O = 61:50:100?
а) K2S2O7;
б) K2S2O4;
в) K2S2O8;
г) K2S2O3.
6. Укажите массу и объем 0,1 моль воды при н.у.:
а) 1,8 г; 2,24 л;
б) 1,8 г; 18 л;
в) 1,8 г; 22,4 л;
г) 0,1 г; 0,1 л;
д) 3,6 г; 22,4 л.
 2015-02-27
2015-02-27 4689
4689