В водородоподобном атоме вокруг ядра с зарядом Ze (Z – порядковый номер химического элемента) движется единственный электрон. К таким атомам относятся атом водорода, ионизированный атом гелия, двукратно ионизированный атом лития. Важность изучения водородоподобного атома заключается в том, что уравнение Шредингера описывает поведение именно одного электрона. Рассмотрение более сложных систем связано с использованием различных приближений.
Потенциальная энергия взаимодействия электрона с ядром зависит от расстояния до ядра r
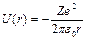 , (2.47)
, (2.47)
где ε 0 – электрическая постоянная
На рис. 2.5, а, показан вид кривой (2.47). Видно, что водородоподобный атом можно рассматривать как потенциальную яму, ограниченную кривой (2.47).
Подставляя (2.47) в уравнение Шредингера для сферических координат, получим уравнение стационарных состояний водородоподобного атома
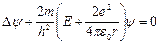 , (2.48)
, (2.48)
где Δ – оператор Лапласа для сферических координат,
ψ – волновая функция в сферических координатах.
 Ze
Ze 
 |
r r
LH m =1
L
0 m =0 n =3 E 3
n =2 E 2 m =-1
n =1 E 1
U
a) б)
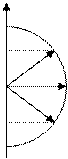
Рис. 2.5. Водородоподобный атом: а – потенциальное поле; б – орбитальный момент
импульса электронов
Уравнение (2.48) имеет довольно объемное решение, поэтому мы здесь ограничимся только основнымирезультатами решения.
1. Электрон в водородоподобном атоме имеет дискретный энергетическийспектр (см. п. 2.4). Собственные значения энергии определяются из выражения
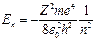 , (2.49)
, (2.49)
где n = 1, 2, 3, … – главное квантовое число.
На рис. 2.5, а показано расположение энергетических уровней.
2. Орбитальныймомент импульса электрона L может принимать лишь ряд дискретных значений.
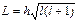 , (2.50)
, (2.50)
где l – орбитальное квантовое число. Оно может принимать значение из следующего ряда. l =0,1,2, …,(n -1). Иногда используют буквенный ряд значений l, l = s, p, d, h.
Так, состояние электрона с n = 1, l = 0 обозначают 1s.
3. Орбитальныймомент импульса L может ориентироваться относительно выбранного направления Н только так, чтобы его проекция LH подчинялась соотношению
LH = mh, (2.51)
где m – магнитное квантовое число.
Оно может принимать значения из ряда m =- l… 0 …l.
Данное соотношение говорит о том, что кроме численного квантования энергии и момента импульса в водородоподобном атоме имеет место пространственное квантование момента импульса (рис. 2.5, б).
Таким образом, состояние электрона в водородоподобном атоме определяется тремя квантовыми числами n, l, m. Как показывают расчеты, плотность вероятности обнаружения электрона на расстоянии r от ядра, определяется следующим образом:
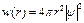 . (2.52)
. (2.52)
Для многоэлектронных атомов, вследствие взаимного влияния электронов, энергия электрона зависит не только от главного n, но и от орбитального и магнитного квантовых чисел. Иными словами, эти квантовые числа определяют энергетический уровень электрона.
Из общих принципов квантовой механики следует, что кроме массы и заряда электрон должен обладать собственным моментом импульса – спином Ls
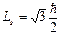 . (2.53)
. (2.53)
Гипотеза о существовании спина была впервые высказана в 1927 г. Гаудсмитом и Уленбеком для объяснения особенностей в линейчатых спектрах и экспериментально доказана в опыте Штерна и Герлаха. Этот опыт показал, что поток электронов в магнитном поле разделяется на два потока, т.е. одни электроны отклоняются к северному, другие – к южному полюсу магнита.
Установлено также, что проекция спина на выбранное направление Н принимает значение LsH
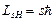 , (2.54)
, (2.54)
где s – спиновое квантовое число s = ±1/2.
Как видим, (2.54) хорошо согласуется с результатами опыта Штерна и Герлаха. В результате можно сделать вывод, что состояние электрона определяется четырьмя квантовыми числами – n, l, m, s.
Все предыдущие рассуждения относились к системам, состоящим из одной частицы, а именно: одного электрона в потенциальной яме, одного электрона в водородоподобном атоме и т.д. Однако в большинстве реальных задач фигурируют системы с большим числом электронов. Например, электроны в атоме, электроны проводимости и т.д. Для многоэлектронных систем, обладающих едиными энергетическими уровнями, существует постулат запрета Паули: в электронной системе возможно существование только одной частицы с одним набором квантовых чисел (n 1, l 1, m 1, s 1). Другая частица должна иметь уже другой набор, например n 1, l 1, m 1, s 2. Отсюда вытекает другая, более важная для нас формулировка постулата Паули: на одном электронном уровне может находиться не более двух электронов с противоположными спинами, т.е. третий электрон должен быть на каком-то другом уровне.
Впоследствии мы будем рассматривать эффекты и явления, на которых основана работа электронных и микроэлектронных устройств и нам понадобятся сведения, изложенные в данной главе. Для самопроверки попытайтесь ответить на вопросы и решить задачи, предлагаемые ниже.
Контрольные вопросы и задания
1.1. В чем смысл гипотезы де Бройля?
1.2. Какое соотношение носит имя де Бройля?
1.3. Электрон, начальной скоростью которого можно пренебречь, прошел ускоряющую разность потенциалов: а) 100 В; б) 500кВ. Определите длину волны электрона.
1.4. В чем физический смысл волны де Бройля?
1.5. Опишите опыт, подтверждающий гипотезу де Бройля.
1.6. Сформулируйте постулат Гейзенберга.
1.7. Определите причины существования неопределенностей координаты, импульса, энергии.
1.8. Запишите выражение для соотношений неопределенностей.
1.9. Кинетическая энергия электрона в атоме водорода составляет 10 эВ. Используя соотношение неопределенности, оцените минимальный размер атома.
2.1. В чем смысл уравнения Шредингера?
2.2. В чем физический смысл волновой функции?
2.3. Запишите условие нормировки.
2.4. Каковы особенности стационарного уравнения Шредингера?
2.5. Что представляет собой решение уравнения?
3.1. В чем смысл условия свободы электрона?
3.2. Запишите решение уравнения для одномерного случая. В чем его смысл?
3.3. Чем отличается решение уравнения Шредингера для трехмерного случая?
3.4. Запишите выражение для энергии свободного электрона.
3.5. Как называют спектр свободного электрона?
3.6. Какую скорость называют фазовой?
3.7. Какую скорость называют групповой?
3.8. Определите фазовую скорость для случаев задачи 1.3.
3.9. Чем характерна вероятность нахождения свободного электрона?
4.1. Что называют потенциальной ямой?
4.2. Какова энергия электрона в яме?
4.3. Назовите особенности волновой функции электрона в потенциальной яме.
4.5. Какова должна быть ширина ямы для того, чтобы минимальная энергия электрона составила 1 эВ?
4.6. Электрон находится в потенциальной яме шириной L. Вычислить вероятность того, что электрон, находящийся в основном состоянии, находится в первой четверти ямы.
5.1. Дайте определение потенциального барьера.
5.2. Приведите примеры потенциальных барьеров.
5.3. Что называют прозрачностью барьера?
5.4. Какой смысл может иметь понятие коэффициент отражения?
5.5. Дайте условия для прозрачности барьера.
5.6. Электрон с энергией Е =5 эВ, движется в положительном направлении оси х. Высота потенциального барьера 5,3 эВ. При какой толщине барьера вероятность прохождения его будет равна 0,2?
5.7. В чем причина возможности туннелирования?
6.1. Что называют линейным гармоническим осциллятором? Приведите примеры.
6.2. В чем особенность квантового осциллятора? Приведите примеры.
6.3. Запишите выражение для энергии осциллятора.
6.4. В чем смысл минимальной энергии осциллятора? Какова ее величина?
6.5. В чем связь понятий фонон и гармонический осциллятор? В чем их различие?
6.6. Определите минимальное расстояние между энергиями осциллятора ν =1 Гц.
7.1. Что называют потенциальной энергией электрона в атоме?
7.2. Приведите выражение для энергии электрона в атоме.
7.3. Дайте понятие орбитального квантового числа.
7.4. Дайте понятие магнитного квантового числа.
7.5. Что называют спином? Чему равен спин электрона?
7.6. Определите минимальный интервал энергии электрона в атоме водорода.
7.7. Сформулируйте постулат Паули.
 ГЛАВА 3
ГЛАВА 3
ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ
В предыдущей главе мы рассматривали поведение микрочастиц в различных условиях, но всякий раз имели в виду один электрон. Однако плотность твердого тела имеет порядок 1028 м-3, и если хотя бы один атом из ста миллиардов освободит свой электрон, то концентрация электронов составит 1017 м-3! Тогда в кубическом миллиметре (средний размер полупроводникового чипа ИС) будет находиться 1011 электронов. Необходимо описать их поведение.
В классической механике поведение тел описывают с помощью уравнений динамики. Этот подход в нашем случае не устраивает в силу нескольких обстоятельств. Решение уравнений для такого количества частиц невозможно и по техническим причинам, и в принципе, поскольку частицы взаимодействуют и между собой, и с узлами кристаллической решетки. Для таких случаев часто используют термодинамическое или статистическое описание.
 2015-02-04
2015-02-04 5263
5263








