Химическую реакцию можно рассматривать с точки зрения изменения в системе количеств продуктов реакции и исходных веществ.
Изменение энергии системы с увеличением числа молей данного вещества на единицу времени при неизменных прочих параметрах системы можно рассмотреть на следующей простой модели.
В сосуде при постоянном давлении и температуре находятся три газа: азот n (N2), кислород n (О2) и водород n (H2) в одинаковых количествах:
n(N2) = n(O2) = n(H2).
Из сосуда можно вывести или (ввести) один моль какого-либо газа, например кислорода. Очевидно, для этого нужно затратить энергию:
Определим изменение энергии Гиббса системы от изменения давления.
Так как V = const, следовательно, изменение mi в системе пропорционально изменению энергии Гиббса системы. Из этого следует, что коэффициент пропорциональности mi характеризует изменение энергии Гиббса системы, связанной с изменением количества вещества.
Для одного моля газа (идеального) V = RT/Р.
С другой стороны, можно рассматривать любой вид энергии как произведение двух величин: фактора интенсивности и фактора емкости.
| Типы энергии | Интенсивная величина | Экстенсивная величина |
| Работа в гравитационном поле | h (высота) | m (масса) |
| Поверхностная энергия | s (поверхностное натяжение) | S (площадь) |
| Электрическая работа | U (напряжение) | q (заряд) |
| Работа расширения газа | Р (давление) | V (объем) |
| Механическая энергия (работа) | F (сила) | l (расстояние, длина) |
| Химическая работа | Химический потенциал | n (кол-во вещества) |
Интенсивная величина (фактор интенсивности), показывающая изменение энергии системы с изменением массы, носит название химического потенциала.
23. Уравнение изотермы химической реакции (Закон действующих масс).
аА + вВ «mM + nN. 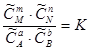 .
.
Уравнение является математическим выражением закона действующих масс, установленного в 1867 году норвежскими учеными К. Гульдбергом и П. Вааге, согласно которому отношение произведения равновесных концентраций продуктов реакции, возведенных в степени, показатели которых равны их стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, показатели которых равны их стехиометрическим коэффициентам, для данной обратимой реакции есть величина постоянная при данной температуре. Эта величина получила название константы химического равновесия.
Принимая во внимание, что изменение энергии Гиббса системы DG=SmiDn, аналогичными рассуждениями можно показать, что
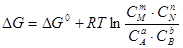 . Приведенное уравнение называют уравнением изотермы химической реакции, или уравнением изотермы Вант-Гоффа. Оно позволяет производить расчет изменения энергии Гиббса при протекании химической реакции. Условия достижения системой состояния равновесия определяются DG= 0, следовательно, можно записать для состояния равновесия:
. Приведенное уравнение называют уравнением изотермы химической реакции, или уравнением изотермы Вант-Гоффа. Оно позволяет производить расчет изменения энергии Гиббса при протекании химической реакции. Условия достижения системой состояния равновесия определяются DG= 0, следовательно, можно записать для состояния равновесия:
DGо = -RTlnK. Подставив значение DGо в уравнение (5.16), получим 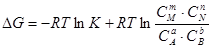 . (5.18)
. (5.18)
Критерием самопроизвольного протекания химического процесса является уменьшение свободной энергии (энергии Гиббса) системы, т.е. DG <0.
Анализ уравнения (5.18) показывает, что это возможно в том случае, если
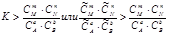 .
.
В этом случае система, находящаяся в неравновесном состоянии, будет стремиться к состоянию равновесия, и при этом концентрация исходных веществ будет уменьшаться, а продуктов – увеличиваться, т.е. реакция будет протекать в прямом направлении. Рассмотрим условие, при котором
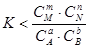 (т.е. DG >0).
(т.е. DG >0).
Если DG > 0, то, следовательно, самопроизвольное протекание прямой реакции невозможно. Однако при этом протекание обратной реакции должно сопровождаться уменьшением энергии Гиббса, т.е. DG <0 и, следовательно, при условии 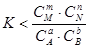 самопроизвольно будет протекать обратная реакция.
самопроизвольно будет протекать обратная реакция.
Уравнение (5.17) можно использовать для расчета констант химического равновесия. Для этого необходимо вычислить изменение стандартной энергии Гиббса, происходящее в результате протекания реакции при постоянных Р и Т. Их расчет приводит по уравнению
DGo = Sni DGo(пр)- Sni DGo(исх). Зная DGo, вычисляют константу химического равновесия:
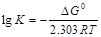 .
.
24. Зависимость константы химического равновесия от температуры. Интегральная и дифференциальная форма уравнения изобары.
Для установления зависимости константы химического равновесия от температуры рассмотрим состояние равновесия химической реакции при произвольных Т1 и Т2. Предположим, что DНo и DSo в интервале температур от Т1 до Т2 остаются постоянными, тогда константы химического равновесия при Т1 и Т2 могут быть выражены:
DG1o = - RT lnK1 DG1o = DНo –T1DSo;
DG2o = - RT lnK2 и соответственно DG2o = DНo –T2DSo.
Решим систему приведенных уравнений относительно константы равновесия химической реакции:
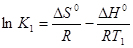 (1),
(1),
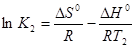 (2).
(2).
Вычтем из первого уравнения второе:
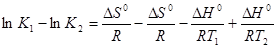
или
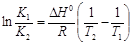 (5.21)
(5.21)
(интегральная форма уравнения изобары).
Полученная зависимость позволяет определить смещение состояния равновесия при изменении температуры. Предположим, что DHo >0 – эндотермическая реакция, тогда при увеличении температуры (Т2>Т1) величина ln K1/K2 < 0, что выполняется при условии K1< K2 (K1/K2 < 1), т.е. равновесие химической реакции смещается в сторону образования продуктов реакции. Уменьшение температуры (Т2<Т1) приведет соответственно к смещению равновесия в сторону образования исходных веществ.
При условии, что реакция – экзотермическая (DHo < 0), повышение температуры (Т2 >Т1) определяет 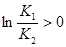 , из чего следует, что K1 > K2 (K1/K2 >1), т.е. равновесие экзотермической реакции при повышении температуры смещается в сторону образования исходных участников реакции, и соответственно, понижение температуры проведения реакции – в сторону продуктов.
, из чего следует, что K1 > K2 (K1/K2 >1), т.е. равновесие экзотермической реакции при повышении температуры смещается в сторону образования исходных участников реакции, и соответственно, понижение температуры проведения реакции – в сторону продуктов.
Часто для анализа направления смещения равновесия химической реакции при изменении температуры удобно пользоваться дифференциальной формой уравнения изобары 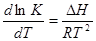 .
.
1) DH < 0; 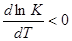
 dT > 0 – для экзотермической реакции увеличение температуры приводит к уменьшению константы химического равновесия, если dT < 0 уменьшение t приводит к росту K (константы химического равновесия);
dT > 0 – для экзотермической реакции увеличение температуры приводит к уменьшению константы химического равновесия, если dT < 0 уменьшение t приводит к росту K (константы химического равновесия);
2) DH > 0; dT > 0 – для эндотермической реакции увеличение температуры ведет к увеличению K;
3) DТ < 0 – для экзотермической реакции уменьшение t ведет к уменьшению К химического равновесия.
Проведенный анализ зависимостей константы химического равновесия показывает, что смещение системы из состояния равновесия путем внешнего воздействия (изменение температуры, давления, концентрации) приводит к увеличению энергии Гиббса, и самопроизвольно могут протекать те процессы, которые противодействуют возрастанию DG, т.е. процессы, связанные с уменьшением энергии Гиббса, что является термодинамическим обоснованием принципа Ле-Шателье.
Принцип смещения равновесия химической реакции, сформулированный Ле-Шателье, а затем Брауном, можно выразить следующим образом: если на систему, находящуюся в устойчивом равновесии, подействовать извне, изменив какое-нибудь из условий, определяющих равновесие, то в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия, и положение сместится в том же направлении.
 2015-02-04
2015-02-04 959
959








