В 1873 г. Ван-дер-Ваальс предложил упрощенную модель межмолекулярных взаимодействий в реальных газах. В этой модели молекулы газа представляют собой абсолютно жесткие притягивающиеся шары, т.е. ветвь, соответствующая силам отталкивания, была строго вертикальной (рис. 10.2).
Существование сил отталкивания между молекулами приводит к уменьшению свободного объема газа, поскольку очевидно, что невозможно сжатием уменьшить объем газа до объема, меньшего, чем суммарный объем всех его молекул. Силы притяжения приводят к сближению молекул и эквивалентны действию на газ некоторого избыточного давления. Тогда уравнение состояния реального газа (в отличие от идеального) принимает вид
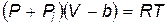 , , | (10.1) |
где P i – дополнительное давление, обусловленное взаимным притяжением молекул; b – недопустимый для сжатия объем, определяющийся силами межмолекулярного отталкивания.
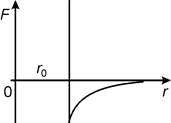 Рис. 10.2 Рис. 10.2 |
Рассмотрим более подробно происхождение поправок P i и b.
Если в газе выделить два единичных объема, в каждом из которых находится n молекул, то сила притяжения между ними пропорциональна числу взаимодействующих пар молекул, т.е. n2. Так как 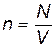 , где N – общее число молекул, а V – объем сосуда, то
, где N – общее число молекул, а V – объем сосуда, то 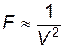 , следовательно, и
, следовательно, и 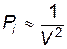 , или
, или
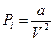 ,
,
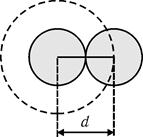 Рис. 10.3 Рис. 10.3 |
где а – некоторая постоянная для данного газа величина.
При относительно невысоких плотностях реального газа столкновения между молекулами могут быть только парными (рис. 10.3). Объем, недопустимый для сближения центров пары молекул 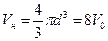 , где V0 – объем молекулы. Очевидно, что объем недоступный для сжатия газа
, где V0 – объем молекулы. Очевидно, что объем недоступный для сжатия газа 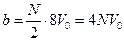 , где N – общее число молекул газа. Таким образом, недоступный для сжатия объем равен учетверенному собственному объему всех молекул газа.
, где N – общее число молекул газа. Таким образом, недоступный для сжатия объем равен учетверенному собственному объему всех молекул газа.
С учетом изложенного уравнение состояния реального газа в приближении Ван-дер-Ваальса можно записать в виде
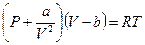 . . | (10.2) |
 2015-02-04
2015-02-04 732
732








