На рис. 10.6 показано семейство изотерм реального газа, рассчитанных по уравнению Ван-дер-Ваальса. В области высоких температур они достаточно близки к экспериментальным. При более низких температурах на теоретических изотермах появляется характерный "завиток", отражающий некоторые детали процессов сжижения газов и испарения жидкостей.
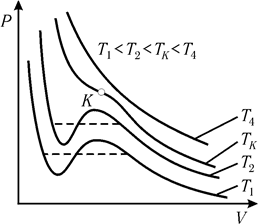 Рис. 10.6 Рис. 10.6 | 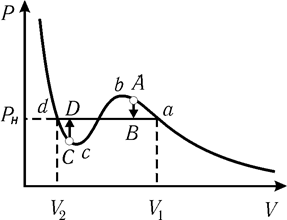 Рис. 10.7 Рис. 10.7 |
Рассмотрим подробнее этот участок.
При сжатии реального газа до объема V1 (рис. 10.7) обычно начинается его сжижение. Однако если газ очищен от примесей (пылинок, ионов и т.д.), которые могут являться центрами конденсации, он может оставаться в газовом состоянии при давлениях, более высоких по сравнению с давлением насыщенного пара – точка А на рис. 10.7. Такое состояние называется пересыщенным паром и является метастабильным (малоустойчивым) – при внесении в него центров конденсации сразу же происходит переход в более устойчивое двухфазное состояние (переход А ® В). Аналогичная картина наблюдается при переходе из жидкого состояния в двухфазное. Чистая жидкость, в которой отсутствуют центры парообразования, может переходить в растянутое (перегретое) малоустойчивое состояние – участок dc на рис. 10.7.
Участок cb изотермы Ван-дер-Ваальса, на котором увеличению давления соответствует увеличение объема, принципиально неустойчив и реализован быть не может.
Следует отметить, что оба метастабильных состояния вещества находят практическое применение при регистрации микрочастиц (камера Вильсона, пузырьковая камера).
 2015-02-04
2015-02-04 1731
1731








