Краткие теоретические сведения
Основные формулы
Уравнение Шредингера для стационарных состояний в сферических координатах:
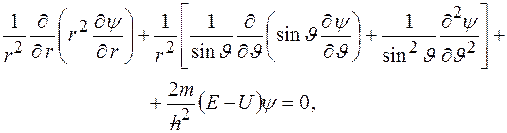
где 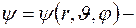 волновая функция;
волновая функция; 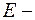 полная энергия частицы;
полная энергия частицы; 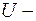 потенциальная энергия частицы (являющаяся функцией координат).
потенциальная энергия частицы (являющаяся функцией координат).
В атоме водорода (водородоподобном ионе) потенциальная энергия 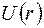
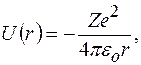
где 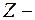 зарядовое число;
зарядовое число;  элементарный заряд;
элементарный заряд; 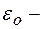 электрическая постоянная.
электрическая постоянная.
Собственное значение энергии:
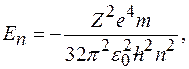
где 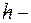 постоянная Планка;
постоянная Планка; 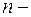 главное квантовое число
главное квантовое число 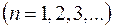 .
.
Символическая запись 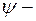 функции, описывающей состояние электрона в атоме водорода,
функции, описывающей состояние электрона в атоме водорода,
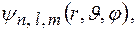
где 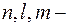 квантовые числа: главное, орбитальное, магнитное.
квантовые числа: главное, орбитальное, магнитное.
Вероятность 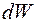 того, что электрон находится в области, ограниченной элементом объема
того, что электрон находится в области, ограниченной элементом объема 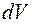 , взятого в окрестности точки с координатами
, взятого в окрестности точки с координатами 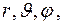
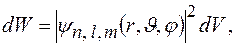
где 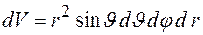 в сферических координатах.
в сферических координатах.
В 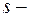 состоянии
состоянии 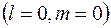 волновая функция сферически-симметричная, т.е. не зависит от углов
волновая функция сферически-симметричная, т.е. не зависит от углов 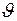 и
и 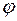 .
.
Нормированные собственные 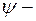 функции, отвечающие
функции, отвечающие 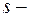 состоянию (основному) и 2
состоянию (основному) и 2 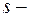 состоянию,
состоянию,
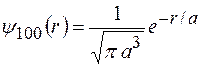 и
и 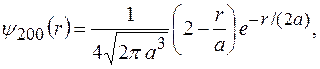
или в атомных единицах
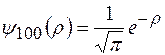 и
и 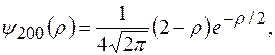
где в качестве единицы длины принят боровский радиус:
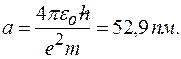
При таком выборе единицы длины расстояние от ядра 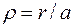 будет выражаться в безразмерных единицах длины, называемых атомными единицами.
будет выражаться в безразмерных единицах длины, называемых атомными единицами.
Вероятность 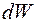 найти электрон в атоме водорода, находящемся в
найти электрон в атоме водорода, находящемся в 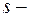 состоянии, в интервале
состоянии, в интервале 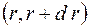 одинакова по всем направлениям и определяется формулой
одинакова по всем направлениям и определяется формулой
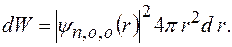
Орбитальные момент импульса и магнитный момент электрона:
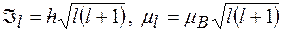 ,
,
где 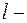 орбитальное квантовое число, которое может принимать значения 0, 1, 2, …,
орбитальное квантовое число, которое может принимать значения 0, 1, 2, …, 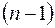 ;
; 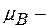 магнетон Бора.
магнетон Бора.
Проекции орбитальных момента импульса и магнитного момента на направление внешнего магнитного поля (совпадающего с осью 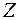 ):
):
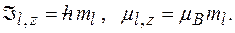
Гиромагнитное отношение для орбитальных магнитного и механического моментов:
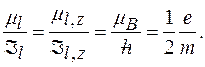
Спин и спиновый магнитный момент электрона:
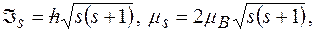
где 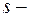 спиновое квантовое число
спиновое квантовое число 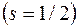 .
.
Проекции спиновых момента импульса и магнитного момента на направление внешнего магнитного поля (совпадающего с осью 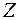 ):
):
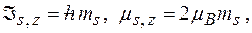
где 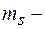 спиновое магнитное квантовое число
спиновое магнитное квантовое число 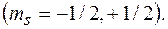
Гиромагнитное отношение для спиновых магнитного и механического моментов:
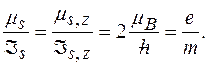
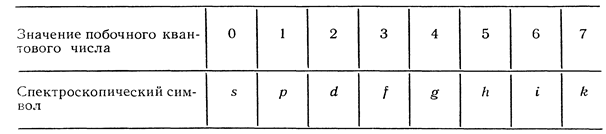
Распределение электронов по состояниям в атоме с помощью спектроскопических символов:
Принцип Паули. В атоме не может находиться два (и более) электрона, характеризуемых одинаковым набором четырех квантовых чисел: 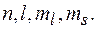
Полный орбитальный момент импульса электрона: 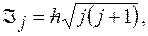 где
где 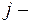 внутреннее квантовое число
внутреннее квантовое число 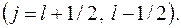
Полный орбитальный момент атома: 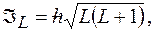 где
где 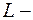 полное орбитальное квантовое число.
полное орбитальное квантовое число.
Полный спиновый момент атома: 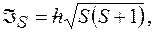 где
где 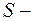 полное спиновое квантовое число.
полное спиновое квантовое число.
Полный момент импульса атома: 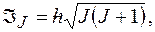 где
где 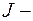 полное внутреннее квантовое число.
полное внутреннее квантовое число.
Символическое обозначение состояния атома (спектральный терм): 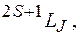 где
где 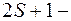 мультиплетность. Вместо полного орбитального квантового числа
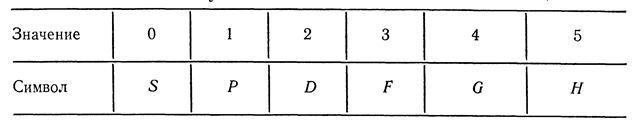
мультиплетность. Вместо полного орбитального квантового числа 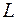 пишут символ в соответствии с таблицей:
пишут символ в соответствии с таблицей:
Энергия атома в магнитном поле: 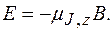
Правила отбора для квантовых чисел 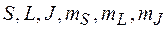 :
:
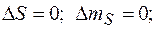
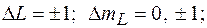
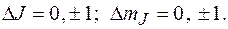
Не осуществляются переходы 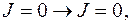 а при
а при 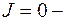 переходы
переходы 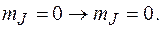
движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию:
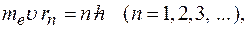
где 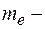 масса электрона,
масса электрона, 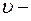 его скорость по
его скорость по 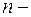 орбите радиуса
орбите радиуса 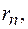
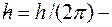 постоянная Планка.
постоянная Планка.
Радиус стационарной орбиты атома водорода:
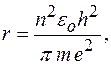
где 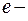 заряд электрона;
заряд электрона; 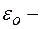 электрическая постоянная.
электрическая постоянная.
Второй постулат Бора (правило частот):
при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией:
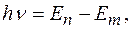
равной разности энергий соответствующих стационарных состояний 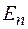 и
и 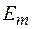 соответственно энергии стационарных состояний атома до и после излучения (поглощения).
соответственно энергии стационарных состояний атома до и после излучения (поглощения).
Кинетическая, потенциальная и полная энергия электрона на орбите соответственно равны:
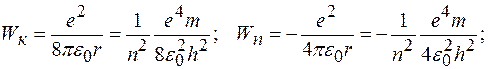
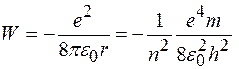
Момент импульса электрона на стационарных орбитах:
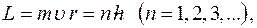
где 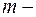 масса электрона;
масса электрона; 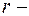 радиус орбиты;
радиус орбиты; 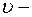 скорость электрона на орбите;
скорость электрона на орбите; 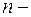 главное квантовое число;
главное квантовое число; 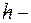 постоянная Планка.
постоянная Планка.
Энергия электрона в водородоподобном атоме:
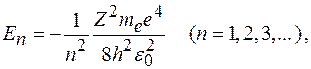
где знак минус означает, что электрон находится в связанном состоянии, 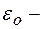 электрическая постоянная.
электрическая постоянная.
Сериальная формула, определяющая длину волны 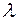 или частоту
или частоту 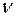 света, излучаемого или поглощаемого атомом водорода при переходе из одного стационарного состояния в другое:
света, излучаемого или поглощаемого атомом водорода при переходе из одного стационарного состояния в другое:
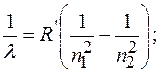
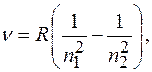
где 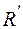 и
и 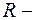 постоянная Ридберга,
постоянная Ридберга, 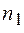 и
и 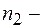 целые числа;
целые числа; 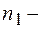 номер серии спектральных линий (
номер серии спектральных линий (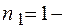 серия Лаймана,
серия Лаймана, 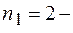 серия Бальмера,
серия Бальмера, 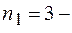 серия Пашена и т.д.);
серия Пашена и т.д.); 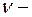 частота излучения. Для данной серии
частота излучения. Для данной серии 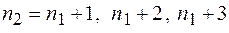 и т.д.
и т.д.
Энергия фотона, испускаемого атомом водорода при переходе из одного стационарного состояния в другое,
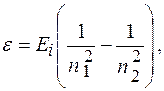
где 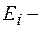 энергия ионизации водорода:
энергия ионизации водорода: 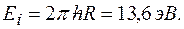
Вопросы для ответа у доски
1. Модель атома Томсона.
2. Рассмотрите случай рассеяния альфа-частиц на ядре атома.
3. В чем суть и результаты опытов Резерфорда?
4. Планетарная модель атома Резерфорда.
5. Сформулируйте постулаты Бора.
6. Изложите суть опытов Франка и Герца.
7. Рассчитайте энергию и радиусы орбит стационарных состояний водородоподобных систем.
8. Что такое энергия и потенциал ионизации атома?
9. Запишите и объясните формулы для серий спектральных линий Бальмера, Лаймана, Пашена, Брэкета.
 2015-02-14
2015-02-14 1547
1547
