Что касается внутренней энергии U, то она зависит только от состояния тела и ее изменение не зависит от промежуточных состояний, в которых тело пребывало.
Термодинамическое состояние системы характеризуется определенной внутренней энергией системы. Однако ни работы, ни теплоты в системе нет. Работа производится системой или над системой, соответственно теплота передается системе или отбирается у системы. Поэтому для приращения внутренней энергии можно записать ΔU = U2 – U1 (здесь U2 и U1 значения внутренней энергии системы в состояниях 1 и 2). Для теплоты и работы таких выражений написать невозможно, поскольку в каждом конкретном состоянии в системе нет ни теплоты, ни работы. Поэтому величины Q и A в формуле (77) не обозначают приращение теплоты и работы.
С математической точки зрения изменение внутренней энергии является полным дифференциалом. Изменение внутренней энергии можно выразить через изменения параметров системы (здесь мы имеем в виду не только идеальный газ):
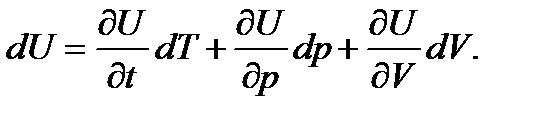
Для теплоты и работы такого выражения написать нельзя, поскольку теплота и работа не являются полными дифференциалами. Для обозначения бесконечно малых изменений таких величин вместо латинской буквы d применяется греческая буква δ, и первое начало термодинамике записывается в следующем виде:
δQ = dU + δA. (80)
 2015-02-15
2015-02-15 835
835







