Уравнение Менделеева — Клапейрона 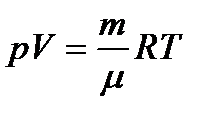 устанавливает связь между тремя основными параметрами р, V и Т, характеризующими данную массу газа. Таким образом, из трех параметров любые два могут рассматриваться как независимые, а третий может быть выражен через них. Выбирая в качестве независимых параметров, определяющих состояние газа, р и V, можно записать температуру в виде
устанавливает связь между тремя основными параметрами р, V и Т, характеризующими данную массу газа. Таким образом, из трех параметров любые два могут рассматриваться как независимые, а третий может быть выражен через них. Выбирая в качестве независимых параметров, определяющих состояние газа, р и V, можно записать температуру в виде

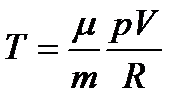 . (94)
. (94)
Это позволяет наглядно изображать с помощью графиков состояние газа и происходящие в нем процессы.
Будем откладывать значения объема газа V на оси абсцисс, а значения давления р — на оси ординат (рис. 35). Каждому состоянию газа, характеризуемому определенными значениями V и р, отвечает на этом графике точка с координатами (V, р). И обратно, точка I на этом графике изображает состояние газа со значениями объема V = V1 и давления р = p1. Соответствующая этому состоянию температура Т = Т1 определится по уравнению (94).
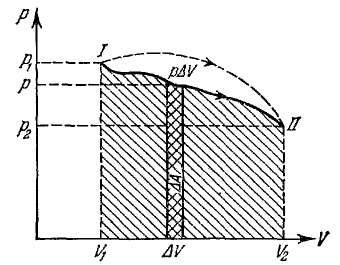
Рис. 35. pV-диаграмма термодинамического процесса
При изменении состояния газа величины р и V (и связанная с ними температура Т) будут непрерывно меняться, а изображающая состояния точка в pV-диаграмме будет перемещаться вдоль некоторой кривой. Сплошная кривая между точками I и II полностью отражает произведенный процесс изменения состояния газа.
С помощью pV-диаграммылегко вычислить работу, совершенную газом при данном процессе. Рассмотрим достаточно малый интервал изменения состояния, когда объем газа изменяется от произвольного значения V до значения V + ΔV. При малом изменении объема ΔV давление можно считать практически постоянным иравным р. Согласно (78) элементарная работа, совершенная газом при расширении на величину ΔV, равна
A = p ΔV. (95)
Из рис. 35 видно, что величина ΔAчисленно равна площади полоски, заштрихованной на этом графике двойной штриховкой. Разбивая полное изменение объема от V1 до V2 на ряд последовательных приращений ΔV, мы найдем полную работу, совершенную газом в течение данного процесса, как сумму площадей таких полосок:
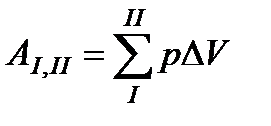 (96)
(96)
В пределе эта работа изобразится полной площадью, заключенной между кривой, изображающей процесс, осью абсцисс и двумя ординатами, восставленными в конечных точках V1 и V2. Эта площадь на рис. 35 показана простой штриховкой.
Условие постоянства давления р при малом изменении объема ΔV будет соблюдаться тем лучше, чем меньше величина ΔV, что хорошо видно из графика. Значение искомой работы АI,II будет вычислено тем точней, чем меньше Δ V, т. е. чем больше полосок помещается между V1 и V2. Точное значение АI,II мы получим, переходя к пределу бесконечно большого числа бесконечно тонких полосок. Такая сумма записывается символически в виде определенного интеграла:

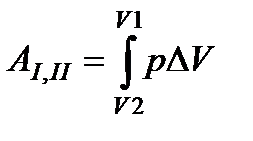 (97)
(97)
Если мы переведем газ из того же начального состояния (V1, p1) в то же конечное состояние (V 2, р2) через другой ряд промежуточных состояний, то этот новый процесс в pV -диаграмме изобразится другой линией, соединяющей те же точки I и II. На рис. 35 такой процесс изображен пунктирной линией.
Как видно из рисунка, площадь, ограниченная сверху пунктирной кривой и численно равная работе А’I,II, при втором процессе отличается от площади, ограниченной первой кривой. Таким образом, работа, совершаемая газом при изменении его состояния, зависит не только от его начального и конечного состояний, но и от пути перехода из одного в другое. Переводя газ из состояния I в состояние II, можно получить самую различную работу, в зависимости от способа («пути») перехода.
Этот вывод нисколько не противоречит закону сохранения энергии — первому началу термодинамики, — поскольку при различных процессах газ не только совершает различную механическую работу, но и получает от окружающих тел различные количества теплоты. Для пояснения этого обстоятельства разберем детальнее несколько простейших процессов с газами, представляющих также и технический интерес.
Термодинамические процессы, происходящие в системе с постоянной массой при каком-либо одном постоянном параметре, называются изопроцессами.
 2015-02-15
2015-02-15 2437
2437








