- характеристика элемента алюминия: электронное строение, возможные степени окисления, основные соединения: оксид, гидроксид, соли.
Алюминий — элемент 13-й группы периодической таблицы химических элементов (элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Электронная конфигурация нейтрального атома 1s22s22p63s23p1 = [10Ne]3s23p1, согласно которой алюминий в соединениях может иметь степень окисления +3 и 0.
Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Основные соединения:
Оксид алюминия Al2O3 – Амфотерный оксид, кислотные и основные свойства равно выражены. Белый, имеет ионное строение (Al 3+) 2(O 2-) 3. Тугоплавкий, термически устойчивый. Аморфный порошок гигроскопичен и химически активен, кристаллический – очень тверд и химически пассивен. Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый Al 2O 3– для изготовления рубиновых лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Cr 2O 3(красный цвет), Ti 2O 3и Fe 2O 3(голубой цвет).
Уравнения важнейших реакций:
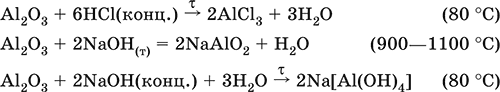
(эта реакция используется для «вскрытия» бокситов)
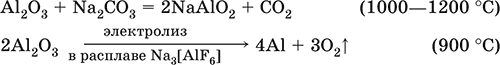
В природе входит в состав глины и бокситов, образует минерал корунд.
Гидроксид алюминияAl(ОН) 3 – Амфотерный гидроксид, кислотные и основные свойства равно выражены. Белый, аморфный (гелеобразный) или кристаллический. Связи Al–ОН преимущественно ковалентные. Разлагается при нагревании без плавления. Практически не растворяется в воде. Реагирует с кислотами, щелочами в растворе и при сплавлении. Не реагирует с NH 3Н 2O, NH 4Cl, СO 2, SO 2и H2S.
Метагидроксид АlO(ОН) химически менее активен, чем Al(ОН) 3. Промежуточный продукт в производстве алюминия. Применяется для синтеза других соединений алюминия (в том числе криолита), органических красителей, как лекарственный препарат при повышенной кислотности желудочного сока.
Уравнения важнейших реакций:
- термическое разложение
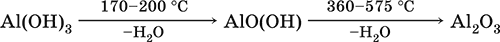
- основная и кислотная диссоциация в растворе
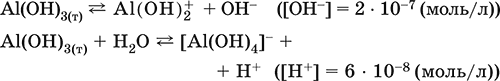
(реакции характеризуют очень малую растворимость в воде и амфотерность гидроксида, поставляющего в раствор одновременно ионы ОН и Н +примерно в равной концентрации; гидроксид диссоциирует слабее, чем сама вода)
- амфотерные свойства
Al(ОН)3+ ЗНСlразб.) = AlCl 3+ ЗН 2O
Al(ОН)3+ NaOH (т)= NaAlO 2+ 2Н 2O (1000 °C)
Al(ОН)3+ NaOH(конц.) = Na[Al(OH) 4] (p)
Для получения осадка Al(ОН) 3щелочь обычно не используют из-за легкости перехода осадка в раствор, а действуют на соли алюминия гидратом аммиака. При комнатной температуре образуется Al(ОН) 3, а при кипячении – менее активный АlO(ОН):
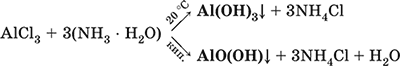
Удобный способ получения Al(ОН) 3– пропускание СO 2через раствор гидроксокомплекса:
[Al(ОН) 4] -+ СO 2= Al(ОН) 3↓ + HCO 3 -
Соли алюминия
Тетрагидроксоалюминат(III) натрияNa[Al(OH) 4] – Комплексная соль. С таким составом существует при комнатной температуре в концентрированном растворе NaOH. Для твердого состояния состав условный, так как при кристаллизации из раствора он усложняется (выделены Na 4[Al(OH) 7], Na 4[Al4O3(OH)10] и др.). При прокаливании твердые соли разлагаются до диоксоалюмината(III) натрия NaAlO2, при разбавлении их растворов – до Al(ОН) 3. По-разному реагируют с сильными и слабыми кислотами, с хлоридом алюминия и карбонатом аммония.
Уравнения важнейших реакций:
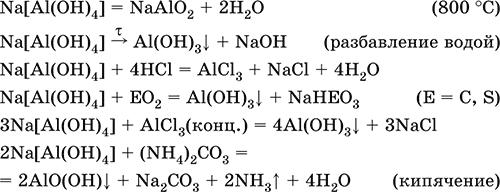
Получение: взаимодействие Al(ОН) 3и солей алюминия с NaOH в концентрированном растворе:
Al(OH) 3+ NaOH(конц.) = Na[Al(OH) 4]
AlCl 3+ 4NaOH(конц.) = Na[Al(OH) 4] + 3NaCl
Образуется из оксида алюминия как промежуточный продукт при промышленном «вскрытии» бокситов.
Хлорид алюминияAlCl 3 – Бескислородная соль. Белый, легкоплавкий, сильнолетучий. В паре состоит из ковалентных мономеров AlCl 3(треугольное строение, sр 2-гибридизация, преобладают при 440–800 °C) и димеров Al 2Cl 6(точнее, Cl 2AlCl 2AlCl 2, строение – два тетраэдра с общим ребром, sр 3-гибридизация, преобладают при 183–440 °C). Гигроскопичен, на воздухе «дымит». Образует кристаллогидрат, разлагающийся при нагревании. Хорошо растворим в воде (с сильным экзо -эффектом), полностью диссоциирует на ионы, создает в растворе сильнокислотную среду вследствие гидролиза. Реагирует со щелочами, гидратом аммиака. Восстанавливается при электролизе расплава. Вступает в реакции ионного обмена.
Качественная реакцияна ион Al 3+– образование осадка AlРO 4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
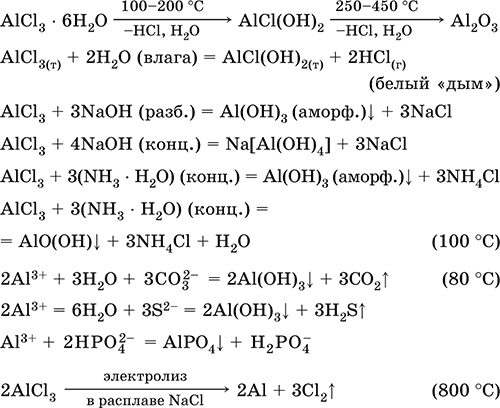
Получение AlCl3в промышленности – хлорирование каолина, глинозёма или боксита в присутствии кокса:
Al 2O 3+ ЗС (кокс) + ЗCl 2= 2AlCl 3+ ЗСО (900 °C)
Сульфид алюминияAl 2S 3 – Бескислородная соль. Белый, связь Al – S преимущественно ковалентная. Плавится без разложения под избыточным давлением N 2, легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, не осаждается из раствора. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода. Уравнения важнейших реакций:
Al 2S 3+ 6Н 2O = 2Al(ОН) 3↓ + 3H 2S↑ (чистый)
Al 2S 3+ 6НCl (разб.) = 2AlCl 3+ 3H 2S↑
Al 2S 3+ 24HNO 3(конц.) = Al 2(SO 4) 3+ 24NO 2↑ + 12H 2O (100 °C)
2Al 2S 3+ 9O 2(воздух) = 2Al 2O 3+ 6SO 2 (700–800 °C)
Получение: взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги:
2Al + 3S = Al2S3(150–200 °C)
Cульфат алюминия-калияKAl(SO 4)2 – Двойная оксосоль. Белый, гигроскопичный. При сильном нагревании разлагается. Образует кристаллогидрат — алюжокалиевые квасцы.Умеренно растворим в воде, гидролизуется по катиону алюминия. Реагирует со щелочами, гидратом аммиака.
Применяется как протрава при крашении тканей, дубитель кож, коагулянт при очистке пресной воды, компонент составов для проклеивания бумаги, наружное кровоостанавливающее средство в медицине и косметологии. Образуется при совместной кристаллизации сульфатов алюминия и калия.
Уравнения важнейших реакций:
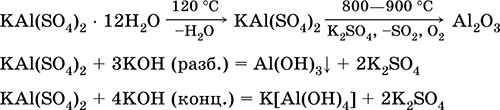
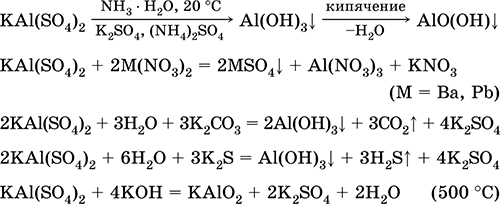
- характеристика элемента железа: электронное строение, возможные степени окисления, основные соединения: оксид, гидроксид, соли.
Железо – элемент 4-го периода и VIIIБ-группы Периодической системы, порядковый номер 26. Электронная формула атома 1s22s22p63s23p63d64s2=[18Ar]3d 64s 2, характерные степени окисления 0, +II и +III (последняя наиболее устойчива).
Шкала степеней окисления железа:
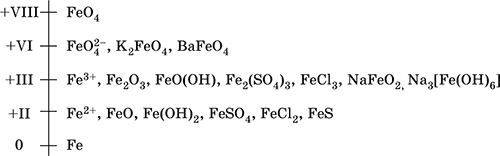
Железо Fe простое вещество. Серый мягкий, ковкий, тугоплавкий металл. Обычное железо медленно окисляется во влажном воздухе (ржавеет), чистое железо коррозии не подвергается. Не реагирует с водой, пассивируется в концентрированных серной и азотной кислотах.
Компактный металл покрывается при нагревании на воздухе оксидной пленкой (окалиной), а порошок сгорает; реагирует с хлором и серой:
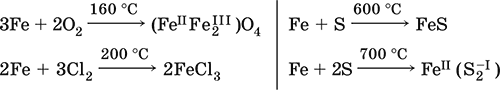
Восстанавливает водяной пар (старый способ получения водорода в промышленности):
3Fe + 4Н 2O (пар) = (Fe IIFe 2 III)O 4+ 4Н 2(800 °C)
В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НCl и H 2SO 4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2Н += Fe 2++ Н 2↑
(реакции проводятся без доступа воздуха, иначе Fe IIпостепенно переводится кислородом в Fe III).
При действии на железо более сильного окислителя (здесь – азотная кислота) оно сразу переходит в катион Fe 3+:
Fe + 4HNO 3(разб.) = Fe(NO 3) 3+ NO↑ + 2H 2O
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fe + 2NaOH (50 %) + 2Н 2O = Na 2[Fe(OH) 4]↓ + Н 2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Железо вытесняет (по ряду напряжений) менее активные металлы из растворов их солей:
Fe + CuSO 4= FeSO 4+ Cu↓
Железо медленно окисляется во влажном воздухе (ржавеет), из-за рыхлости коричневой ржавчины (Fe IIFe 2 III)O 4защитный слой не создается. Процесс ржавления:
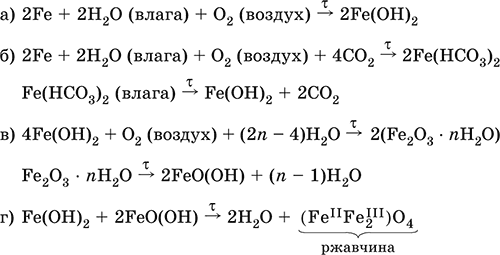
Техническое железо – сплавы железа с углеродом: чугун содержит 2,06—6,67 % С, сталь 0,02—2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Mn, Ni, Cr), что придает сплавам железа технически полезные свойства – твердость, термическую и коррозионную стойкость, ковкость и др.
Оксид железа(II)FeO – Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fe 2+O 2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
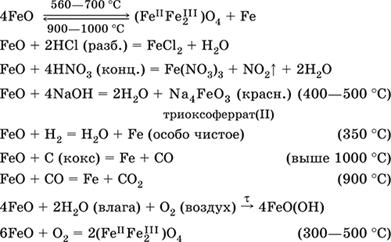
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fe(OH) 2= FeO + H 2O (150–200 °C)
FeCO 3= FeO + СO 2(490–550 °C)
Оксид дижелеза (III) – железа(II) (Fe IIFe 2 III)O4 – двойной оксид. Черный, имеет ионное строение Fe 2+(Fe 3+) 2(O 2-) 4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe 3O 4не рекомендуется. Уравнения важнейших реакций:
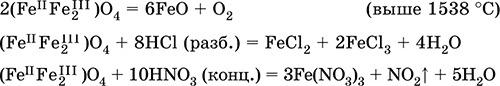
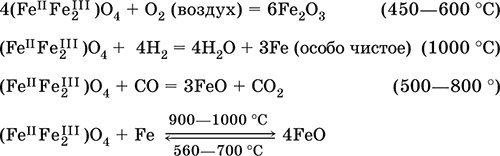
Получение: сгорание железа (см.) на воздухе.
В природе – оксидная руда железа магнетит.
Оксид железа(III)Fe 2O 3 – Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fe 3+) 2(O 2-) 3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fe 2O 3nН 2O. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
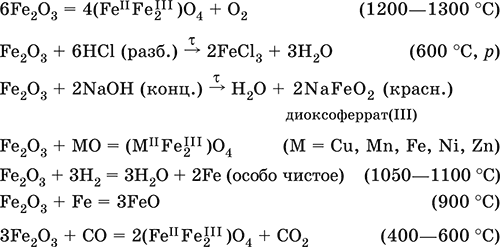
Получение в лаборатории – термическое разложение солей железа(III) на воздухе:
Fe 2(SO 4) 3= Fe 2O 3+ 3SO 3(500–700 °C)
4{Fe(NO 3) 39 H 2O} = 2Fe aO 3+ 12NO 2+ 3O 2+ 36H 2O (600–700 °C)
В природе – оксидные руды железа гематит Fe 2O 3и лимонит Fe 2O 3nН 2O.
Гидроксид железа (II)Fe(OH) 2 – Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fe – ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
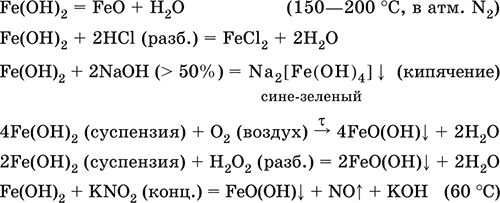
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fe 2++ 2OН(разб.) = Fe(OH) 2↓
Fe 2++ 2(NH 3H 2O) = Fe(OH) 2 ↓ + 2NH 4 +
Метагидроксид железаFeO(OH) – Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fe–О и Fe – ОН преимущественно ковалентные.
При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fe 2O 3nН 2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FeO(OH). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fe(OH) 2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fe(OH) 3не известно (не получено).
Уравнения важнейших реакций:
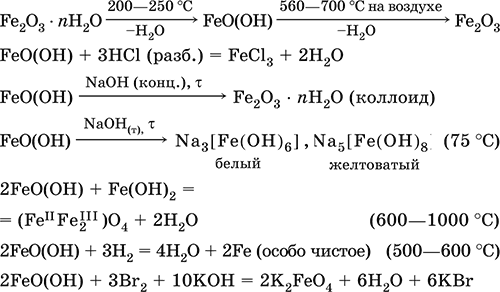
Получение: осаждение из раствора солей железа(III) гидрата Fe 2O 3nН 2O и его частичное обезвоживание (см. выше).
В природе – оксидная руда железа лимонит Fe 2O 3nН 2O и минерал гётит FeO(OH).
Соли железа:
Феррат калияK 2FeO 4 – Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция – образование красного осадка феррата бария. Применяется в синтезе ферритов – промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
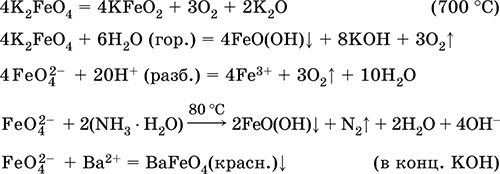
Получение: образуется при окислении соединений железа, например метагидроксида FeO(OH), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fe + 2KOH + 2KNO 3= K 2FeO 4 + 3KNO 2+ H 2O (420 °C)
и электролизе в растворе:
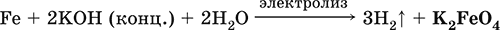
(феррат калия образуется на аноде).
Качественные реакции на ионыFe 2+и Fe 3+. Обнаружение ионов Fe 2+и Fe 3+в водном растворе проводят с помощью реактивов K 3[Fe(CN) 6] и K 4[Fe(CN) 6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, KFe III[Fe II(CN) 6]. В лаборатории этот осадок называют берлинская лазурь,или турнбуллева синь:
Fe 2++ К ++ [Fe(CN) 6] 3-= KFe III[Fe II(CN) 6]↓
Fe 3++ K ++ [Fe(CN) 6] 4-= KFe III[Fe II(CN) 6]↓
Химические названия исходных реактивов и продукта реакций:
K 3[Fe(CN) 6] – гексацианоферрат (III) калия
K 4[Fe(CN) 6] – гексацианоферрат (II) калия
KFe III[Fe II(CN) 6] – гексацианоферрат (II) железа(III) калия
Кроме того, хорошим реактивом на ионы Fe 3+является тиоцианат-ион NCS -, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fe 3++ 6NCS– = [Fe(NCS) 6] 3-
Этим реактивом (например, в виде соли KNCS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
Хлорид железа(Н)FeCl 2 – Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке HCl. Связи Fe – Cl преимущественно ковалентные, пар состоит из мономеров FeCl 2(линейное строение, sp-гибридизация) и димеров Fe 2Cl 4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо -эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FeCl 3и Fe 2O 3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций
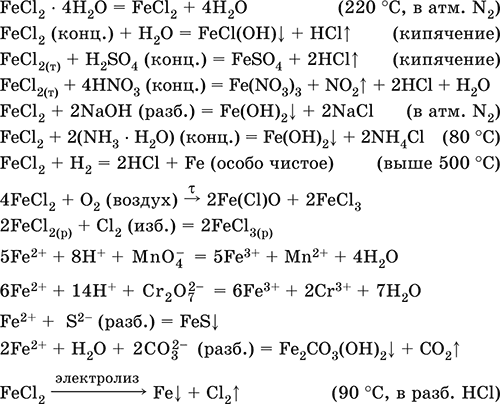
Получение: взаимодействие Fe с соляной кислотой:
Fe + 2НCl = FeCl 2+ Н 2↑
(в промышленности используют хлороводород и ведут процесс при 500 °C).
Хлорид железа(III)FeCl 3 – Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fe – Cl преимущественно ковалентные. Пар состоит из мономеров FeCl 3(треугольное строение, sр 2-гибридизация, преобладают выше 750 °C) и димеров Fe 2Cl 6(точнее, Cl 2FeCl 2FeCl 2, строение – два тетраэдра с общим ребром, sр 3-гибридизация, преобладают при 316–750 °C). Кристаллогидрат FeCl 36Н 2O имеет строение [Fe(H 2O) 4Cl2]Cl • 2Н 2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
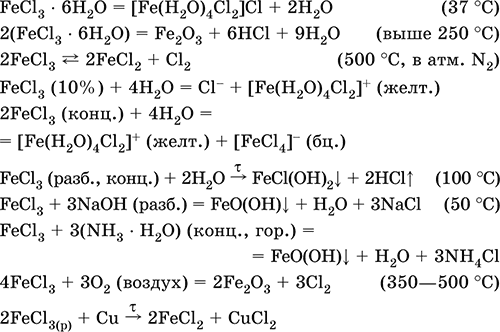
Сульфид железа (II)FeS – Бескислородная соль. Черно-серый с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Соединение железа(III) состава Fe 2S 3не известно (не получено).
Уравнения важнейших реакций:
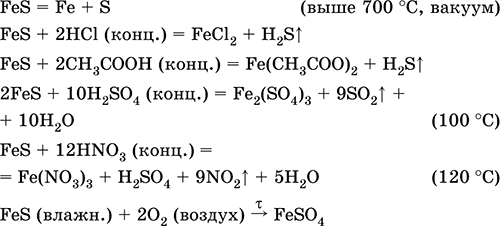
Получение:
Fe + S = FeS (600 °C)
Fe 2O 3+ H 2 + 2H 2S = 9 FeS + 3H 2O (700-1000 °C)
FeCl 2+ 2NH 4HS (изб.) = FeS ↓ + 2NH 4Cl + H 2S↑
Дисульфид железаFeS 2 – Бинарное соединение. Имеет ионное строение Fe 2+(—S – S—) 2-. Темно-желтый, термически устойчивый, при прокаливании разлагается. Нерастворим в воде, не реагирует с разбавленными кислотами, щелочами. Разлагается кислотами-окислителями, подвергается обжигу на воздухе. Применяется как сырье в производстве чугуна, серы и серной кислоты, катализатор в органическом синтезе. В природе – рудные минералы пирит и марказит.
Уравнения важнейших реакций:
FeS 2= FeS + S (выше 1170 °C, вакуум)
2FeS 2+ 14H 2SO 4(конц., гор.) = Fe 2(SO 4) 3+ 15SO 2↑ + 14Н 2O
FeS 2+ 18HNO 3(конц.) = Fe(NO 3) 3+ 2H 2SO 4+ 15NO 2↑ + 7H 2O
4FeS 2+ 11O 2(воздух) = 8SO 2+ 2Fe 2O 3(800 °C, обжиг)
Сульфат железа (II)FeSO 4 – Оксосоль. Белый (гидрат светло-зеленый, техническое название железный купорос), гигроскопичный. Разлагается при нагревании. Хорошо растворим в воде, в малой степени гидролизуется по катиону. Быстро окисляется в растворе кислородом воздуха (раствор желтеет и мутнеет). Реагирует с кислотами-окислителями, щелочами, гидратом аммиака. Типичный восстановитель.
Применяется как компонент минеральных красок, электролитов в гальванотехнике, консервант древесины, фунгицид, лекарственное средство против анемии. В лаборатории чаще берется в виде двойной соли Fe(NH 4) 2(SO 4) 26Н 2O (соль Мора), более устойчивой к действию воздуха.
Уравнения важнейших реакций:
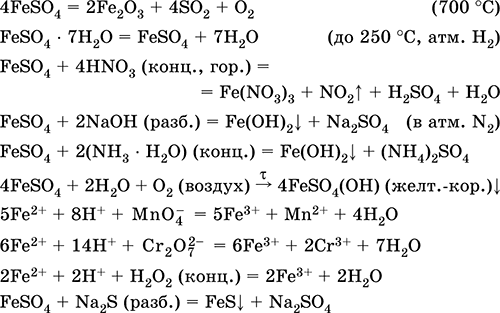
Получение:
Fe + H 2SO 4(разб.) = FeSO 4 + H 2↑
FeCO 3+ H 2SO 4(разб.) = FeSO 4 + CO 2↑ + H 2O
- применение соединений алюминия и железа.
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Алюминий широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки. Первые же три свойства сделали алюминий основным сырьем в авиационной и авиакосмической промышленности (в последнее время медленно вытесняется композитными материалами, в первую очередь, углеволокном).
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Меньшую электропроводность алюминия (37 ом−1) по сравнению с медью (63 ом−1) компенсируют увеличением сечения алюминиевых проводников. Недостатком алюминия как электротехнического материала является наличие прочной оксидной плёнки, затрудняющей пайку и за счет большего сопротивления вызывающей повышенное нагревание в местах электрических соединений — что, в свою очередь, отрицательно сказывается на надежности контакта и состоянии изоляции.
Благодаря комплексу свойств широко распространён в тепловом оборудовании.
Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике.
Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал.
В производстве строительных материалов как газообразующий агент.
Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, например клапанам поршневых ДВС, лопаткам турбин, нефтяным платформам, теплообменной аппаратуре, а также заменяют цинкование.
Сульфид алюминия используется для производства сероводорода.
Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
Как компонент термита, смесей для алюмотермии
В пиротехнике.
Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
Ограничено применяется как протектор при анодной защите.
Сплавы на основе алюминия.
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе.
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твёрдых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
 2015-02-15
2015-02-15 12323
12323
