Из уравнений (1.1) и (1.2) следует, что
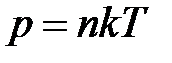 .
.
Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, 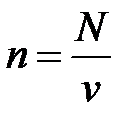 , получим:
, получим: 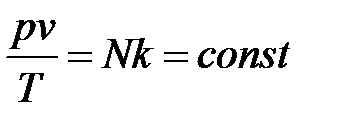 .
.
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
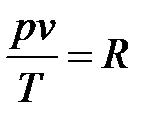 , или
, или 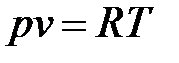 , (1.3)
, (1.3)
Полученное соотношение представляет собой уравнение Клапейрона.
Умножив (1.3) на М, получим уравнение состояния для произвольной массы газа М:
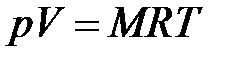 , (1.4)
, (1.4)
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М= μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева:
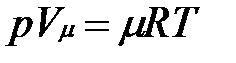 .
.
Здесь 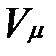 — объем киломоля газа, а
— объем киломоля газа, а 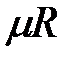 — универсальная газовая постоянная.
— универсальная газовая постоянная.
В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому
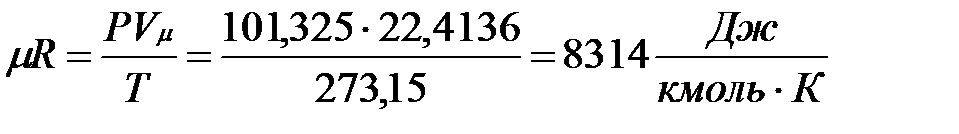 .
.
Газовая постоянная 1 кг газа составляет
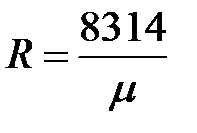 .
.
 2015-02-18
2015-02-18 1976
1976
