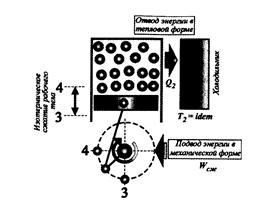
Рис. 3.17. Сжатие рабочего тела при постоянной температуре.
При сжатии к рабочему телу извне подводится механическая энергия. Внешняя работа преобразуется во внутреннюю энергию рабочего тела. Чем круче проходит кривая сжатия, тем больше ее удаление от оси абсцисс, тем большая механическая энергия затрачивается на сжатие рабочего тела. Для увеличения площади цикла желательно, чтобы на первом этапе кривая сжатия 3-4 на индикаторной диаграмме шла менее круто. Как было показано выше, этому условию удовлетворяет изотермический процесс.
Второй этап сжатия – от точки 4 до точки1 (исходной точки цикла) по индикаторной диаграмме (рис. 3.18).
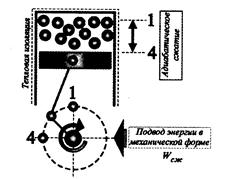
Рис. 3.18. Сжатие рабочего тела по адиабате без теплообмена
с окружающей средой.
Адиабата позволяет замкнуть цикл с помощью крутой кривой. Таким образом, в результате осуществления четырех процессов цикл Карно замыкается. Рабочее тело прошло полный замкнутый цикл, а поршень совершил два хода (такта). Следует заметить, что в цикле Карно рабочее тело не покидает пределов системы (не выбрасывается наружу). Т.е. рассматриваемая термодинамическая система является замкнутой.
Коэффициент полезного действия цикла Карно определится (см рис.3.14) отношением площадей
Влияние температур на величину полезной работы цикла Карно показано на рис.3.19.
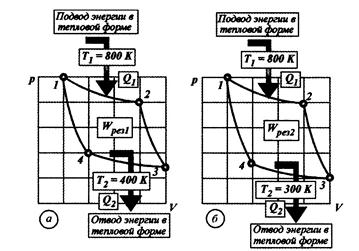
Рис.3.19. Зависимость полезной работы цикла Карно
от температуры холодильника.
Карно первым показал возможность проведения цикла не только в прямом (как описано выше), но и в обратном направлении (см. рис.3.20 и 3.21).
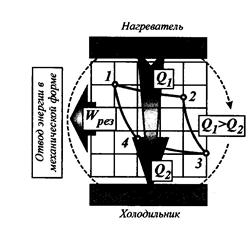
Рис.3.20. Условная схема работы тепловой машины
Карно по прямому циклу.
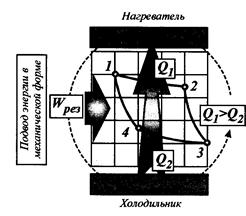
Рис. 3.21. Условная схема работы тепловой машины
Карно по обратному циклу.
Обратный цикл работы тепловой машины принято называть холодильным циклом. В результате работы такой тепловой машины теплота передается от тел с более низким уровнем температур телам с более высоким уровнем температур. Такая передача самопроизвольно происходить не может и требует затраты энергии. Холодильные циклы будут рассмотрены позднее.
Карно для прямого цикла расписал баланс энергий и предложил понятие коэффициента полезного действия цикла.
Баланс энергий: Q1 = Lполез + Q2, а КПД:
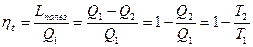
Предложенная Карно формулировка термического КПД цикла применяется до сих пор.
Как известно, Карно свои рассуждения строил на ошибочном понятии теплорода. Уже при его жизни это понятие критиковалось и признавалось ошибочным, но выводы Карно получил потрясающие.
Более квалифицированный анализ работы Карно произвел армейский инженер Эмиль Клапейрон. Именно благодаря последнему мы можем судить о вкладе Карно в термодинамику. Дальнейшие исследования проведены в трудах Рудольфа Клазиуса и лорда Кельвина.
Клаузиус предложил ввести интересную функцию состояния вещества Q1/T1 и Q2/T2. Он показал, что для любого замкнутого цикла разность (Q1/T1 - Q2/T2) =0 (это утверждение называют первой теоремой Клаузиуса). Клаузиус предложил назвать функцию Q/T энтропией, объяснив свое желание тем, что это название в переводе с греческого означает «превращение». Ему хотелось, чтобы название было созвучно со словом «энергия».
Анализируя циклы работы тепловых двигателей, Клаузиус показал, что вне зависимости от рабочего тела и от пути проведения изменений процессов в цикле интеграл изменения энтропии равен 0.
Условие необходимости отвода тепла из цикла привела его к мысли, что все процессы протекают с увеличением энтропии. Он утверждал, что энтропия в замкнутой системе стремится к максимуму (это его утверждение называют второй теоремой Клаузиуса)
Дальнейшие рассуждения автора понятия энтропии привели его к тому выводу, что это понятие может быть отнесено к планете Земля и к вселенной в целом. Энтропия при рассеянии энергии стремится к росту. Опыт показывает, что все действия человека приводят к рассеянию энергии, находившейся ранее в концентрированном состоянии. Клаузиус сделал вывод, что все процессы, как на земле, так и во вселенной способствуют рассеянию энергии, т.е. энтропия системы стремится к максимуму, и неизбежна тепловая смерть.
С точки зрения философии именно рассуждения Клаузиуса дали понятие направления развития жизни во времени. Жизнь идет в направлении увеличения энтропии. Необратимые процессы способствуют увеличению энтропии и бесполезного тепла. Рост температуры окружающей среды со временем скажется на эффективности тепловых двигателей. Полезные ископаемые, используемые человечеством, при добыче обладают минимальной энтальпией. В процессе сгорания горючих материалов происходит увеличение энтропии и рассеяние ее в пространстве.
Упорядоченная энергия Солнца излучается безвозвратно в космическое пространство, увеличивая его неупорядоченность. Имеется аналогия между информацией о состоянии тел и энтропией. Упорядоченные тела имеют предсказуемые свойства, положение частиц. Увеличение температуры за счет подвода тепла (а теплота по определению однозначно связана с энтропией) снижает уровень информации о положении отдельных точек тел. Переход к газообразному состоянию и плазме все менее позволяет говорить о конкретной информации о теле. Для оценки этих характеристик начинают применять статистические методы. Т.е. однозначно можно говорить, что увеличение энтропии понижает информацию.
Клаузиус предположил неизбежность тепловой смерти в тот момент, когда произойдет рассеяние веществ и энергии в пространстве.
С этим положением начали бороться материалисты. В своей книге «Диалектика природы» Фридрих Энгельс отрицал такое развитие событий. С точки зрения материализма, если есть факт смерти, значит должен быть факт однозначного зарождения жизни. Вековые наблюдения не дают оснований для нахождения начальной точки развития, а следовательно и говорить о конечной точке неправомерно.
Но современные физики пришли к выводу (и нашли этому доказательства), что был первоначальный Взрыв. Он отстоит от настоящего времени примерно на 10-12 миллиардов лет. Теория о первоначальном взрыве возвращает нас к утверждению о конце мира.
Единственным природным процессом, имеющим антиэнтропийную направленность, является биогенез – преобразование солнечной энергии в живую материю растениями, а растения дают возможность развиваться животному миру.
Вот так энергетические рассуждения термодинамиков влияют на познание не только земных процессов (чем занимаются и другие науки), но и описать явления во всей окружающей нас Вселенной.
Третий закон термодинамики гласит, что достижение абсолютного нуля отбором механической работы невозможно. Подробно это явление исследовал Нернст. Иллюстрации трудности понижения температуры в системах турбодетандеров и дросселированием мы рассмотрим позже.
Одна из формулировок (принадлежащая М.Планку) гласит, что энтропия системы при достижении абсолютного нуля температур равна нулю. Нулю равны и теплоемкости веществ при достижении абсолютного нуля температур.
Четвертым законом называют факт передачи тепла только в одном направлении – от тела с более высоким уровнем температуры к телу с более низким уровнем температуры вне зависимости от фазового состояния тел.
3.3.1. Термодинамическая аналогия..
Как было показано выше, термодинамика позволяет анализировать все происходящие в природе явления с единой точки зрения.
В [1] приводится следующая фомулировка науки термодинамика: «Т ермодинамика (по-гречески therme –теплота, жар и dynamikos – относящийся к силе, силовой) – это всеобъемлющая наука, которая изучает свойства (состояния) материи и процессы ввзаимодействия тел природы в их взаимной связи....
Как известно, движение неотделимо от материи, оно представляет собой способ существования материи. Фундамент термодинамической теории составляет понятие элементарной формы движения материи. Для краткости элементарная форма движения именуется иногда элементарным движением. Если нет специальных оговорок, то под термином форма движения материи также понимается элементарная форма движения. »
Число элементарных форм движения материи безгранично, они являются кирпичиками общего понимания энергии и работы. Все эти формы движения материи находятся в неразрывной связи между собой. По мере необходимости с учетом конкретных условий они имеют возможность или вынуждены превращаться в любую другую форму движения.
Автор [5] сформулировал общий подход к изучению явлений различных форм движения материи. Он пишет: «Для каждой элементарной формы движения материи существует (и может быть найден) характерный параметр Е, который с качественной и количественной стороны однозначно определяет эту форму движения, а, следовательно, и все (макроскопические и микроскопические) свойства (состояния) материи в той мере, в какой они связаны с этой формой движения.
Параметр Е называется обобщенным зарядом (или просто зарядом). В литературе его именуют также фактором экстенсивности или координатой состояния.»
Другой координатой автор предлагает считать связанный с ним параметр под названием потенциала. Потенциал, как это будет ясно из дальнейших рассуждений, есть движущая сила, обуславливающая возможность рассматриваемого явления. Потенциалом могут служить такие величины, как сила, момент силы, угловая скорость, давление, абсолютная температура, химический и электрический потенциалы и т.д. и т.п. Потенциал – это величина, определяющая физическую возможность проявления рассматриваемого явления. Изменение потенциала проявляется в появлении работы, видоизменении энергии и другие переходы. Если потенциал неизменен (несмотря на наличие обобщенного заряда), то рассматриваемое явление не может проявиться. Для пояснения несколько примеров:
- если массивное тело находится на какой-то высоте от уровня земли, оно не может совершить работу; для начала изменения потенциальной энергии надо предоставить возможность телу переместиться по высоте ΔН. Здесь заряд – mg (произведение массы тела на земное ускорение), потенциал –ΔН.
- если тело любой массы и теплоемкости имеет температуру, совпадающую с температурой окружающих тел среды, то процесса передачи тепла мы не выявим. При наличии разности температур ΔТ произойдет процесс теплообмена. Здесь mcp (произведение массы на удельную теплоемкость) – обобщеный заряд, а ΔT – потенциал.
-если электрический проводник обладает потенциалом U, не отличающимся от потенциала окружающих тел (ΔU=0), то не приходится говорить о возможности появления тока I, здесь I – обобщенный заряд, а ΔU –потенциал.
Произведение обобщенного заряда на изменение потенциала всегда равно работе или выделению (поглощению) энергии. Последнее положение подтверждает мысль, что для выделения (поглощения) энергии необходимо изменение потенциала. Масштабом выделения (поглощения) энергии является обобщенный заряд.
Рассмотрение переходов энергии с точки зрения аналогии позволяет находить эквиваленты потребных изменений потенциалов для обеспечения требуемого результата (например, какая должна быть высота подъема тела над уровнем земли ΔН для достижения уровня кинетической скорости движения рассматриваемого тела – Δ(υ2/2); достаточно приравнять эти величины и произвести вычисления.
В таблице №3.4 приводятся сведения о наиболее применяемых в технике аналогий.
Таблица№3.4 Термодинамические потенциалы и заряды
для наиболее часто применяемых видов энергии.
| Вид энергии | Потенциал | Обобщенный заряд | Энергия, работа |
| Потенциальная | Н | mg | Eпот = mg·ΔH |
| Кинетическая | υ2 /2 | m | Екин = m·Δ(υ2/2) |
| Давления | р | V | Есж = V· Δр |
| Перемещения | S | F | Епер = F·ΔS |
| Тепловая | Т | mср | Етеп = mср· ΔТ |
| Электрическая | U | I | Еэлек = I·ΔU |
Список явлений и аналогий можно продолжить для всех видов энергий, перечисленных в таблице №3.1.
Техническая работоспособность – эксергия.
Развитием понятия термодинамических потенциалов в середине 50-х годов ХХ века стало создание еще одного обобщенного понятия, позволяющего анализировать совершенство процесов, изучаемых технической термодинамикой, т.е. раздела термодинамики, изучающим совершенство реальных процессов тепловых машин. Вновь введенное понятие назвали эксергией.
Изучая цикл Карно, Клаузиус пришел к выводу, что в адиабатной изолированной системе при наличии в цикле обратимых процессов энтропия системы ∆Sсист =0.
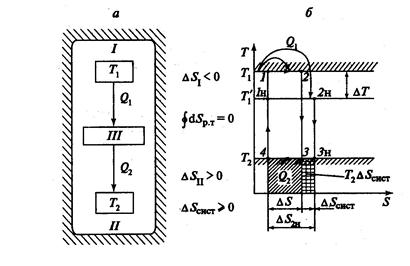
Рис. 3.22. Сравнение обратимого и необратимого циклов Карно.
Реальные процессы протекают в условиях неравновесных процессов, когда даже изотермическое сжатие осуществляется ступенчато (после каждой ступеньки повышения давления со скачкообразным ростом температуры рабочего тела следовало охлаждение его также ступенькой). Все процессы протекают с наличием гидравлических и механических потерь, что создает безвозвратные для рабочего тела и процессов с ним потерь энергии, части выполняемой работы расширения (сжатия). И в реальных процессах ∆Sсист >0.
Рис.3.22. схематично изображает сравнение обратимого и необратимого циклов Карно.
Видно, что недополученная из-за дополнительного отвода тепла полезная техническая работа уменьшается на величину
L – Lнеобр = ∆Lпотерь = T2∆Sсист (^^)
Любая другая необратимость также увеличивает возрастание энтропии системы и требует дополнительного отвода теплоты от рабочего тела для замыкания цикла и, следовательно, недополучения работы.
Хочется остановиться на расширении понятия физического смысла энтропии:
- в равновесных процессах энтропия – это тепловая координата, изменение которой показывает направление теплообмена и позволяющее определять его количественно;
- в неравновесных процессах энтропия является, кроме того, мерой неравновесности и мерой потери работоспособности системы.
Энтропия системы в необратимых процессах возрастает за счет увеличения энтропии приемника теплоты, которым, в конечном счете, является окружающая среда.
При одинаковых последствиях необратимости протекания процессов (потеря работоспособности) причины их могут быть различными.
Диссипацией энергии (рассеянием, потерей качества) принято называть самопроизвольный необратмый процесс преобразования энергии 1-го, например работы в теплоту трения.
Деградацией энергии (обесцениванием, потерей качества) принято называть, самопроизвольный необратимый процесс преобразования энергии 2-го и 3-го родов (охлаждение тел, дросселирование газа, процессы смешения потоков и т.д.).
Рассмотрим процесс рассуждения автора понятия эксергии З. Ранта, предложившего это понятие в 1956 году. Термин эксергия состоит из двух частей: греческого слова «erg(on)» - «работа, сила» и приставки «ех», означающей «из», «вне». Часть энергии, которая не является эксергией, позже, в 1962 году, З.Рант назвал «анергией», где приставка «ан» означает отрицание «не» или «нет».
Использование понятий эксергии и анергии позволило автору говорить о неограниченно и ограниченно превратимых формах знергии. Ораниченно превратимые виды энергии можно преобразовать в эксергию только частично. Часть энергии в эксергию не превратима. Энергия в этом случае состоит из эксергии и анергии. Каждая из этих составляющих, в общем случае, может равняться нулю. Так, например, анергия электрической энергии равна нулю. А для энергии окружающей среды равна нулю эксергия.
В любом процессе сумма эксергии и анергии равна затраченной энергии.
Поведение эксергии и анергии можно сформулировать так:
1. При протекании обратимых процессов эксергия остается неизменной.
2. В ходе необратимых процессов эксергия теряется и превращается в анергию.
3. Анергию в эксергию превратить невозможно.
Здесь следует обратить внимание на понятие «теряется». Термины «потеря энергии» и
«потеря эксергии» имеют принципиальное отличие содержания. Потеря энергии, по существу, означает потерю не вообще (энергия, как известно, не исчезает), апотерю дляданного тела или данной системы. Потеря же эксергии, напротив, означает ее полное исчезновение, уничтожение и переход в анергию.
Эксергией называют максимальную работу, которую может совершить система при ее переходе от данного состояния в равновесие с окружающей средой. Эксергия может иметькак положительное, так и отрицательное значение. Под отрицательной эксергией понимают минимальное количество работы, которую должна затратить система, чтобы отвести теплоту Q от тела с данной температурой в окружающую среду.
Различают эксергию теплоты и эксергию рабочего тела в потоке.
Максимальную работу можно получить лишь в равновесных обратимых процессах, осуществляя их по адиабатам и изотермам (в том или ином сочетании).
Максимальную работу можно получить преобразованием теплоты только в обратимом цикле Карно, следовательно, эксергия теплоты
ЕхQ = Lк = QηtК = Q(1-То/Т)
Эксергия теплоты графически показана на рисунке 3.23, где То –температура окружающей среды; Ан –анергия, не преобразуемая в работу часть теплоты Q.
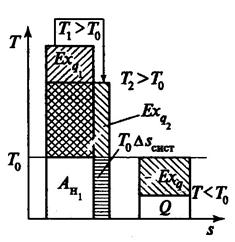
Рис. 3.23. Эксергия теплоты.
Эксергия рабочего тела в потоке определеяется максимальной работой потока, полученной при обратимом переходе из состояния 1 (рис.3.24) в равновесие с окружающей средой (параметры ро,То)
а б
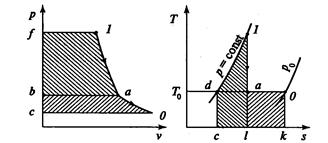
Рис. 3.24. Эксергия рабочего тела в потоке в рv-(а) и ТS-(б) диаграммах
Эта работа является суммой двух работ – в процессе адиабатного расширения 1-а (площадь 1-а-b –f на рис.3.24а и площадь 1- l – c – d на рис. 3.24 б) и в процессе изотермического расширения (площадь a – o – c – b на рис.3.24а и площадь a – o – k – l на рис.3.24б).
Удельная энергия рабочего в потоке
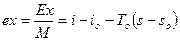
Любое отклонение протекания реальных процессов от обратимых изотерм и адиабат приводит кпотере эксергии из-за необратимости.
Так при передаче теплоты Q от тела с температурой Т1 к телу с более низкой температурой Т2 происходит уменьшение эксергии и увеличение анергии (рис.3.23):
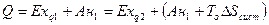
При сохранении количества теплоты происходит потеря ее качества – способности производить работу, деградация энергии. Потеря эксергии тем выше, чем выше возрастание энтропии системы вследствие необратимости процессов, происходящих в системе:
∆Ex = То∆Sсист (^^^)
Это выражение справедливо и для потери эксергии рабочего тела в потоке.
Формулы (^^) и (^^^), связывающие потерю работы (эксергии) с величиной возрастания энтропии системы вследствие необратимости протекающих в системе процессов, называют формулой Гюи-Стодола.
Эксергетический КПД цикла есть отношение полезно использованной эксергии 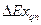 ко всей израсходованной эксергии
ко всей израсходованной эксергии 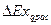 :
:
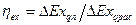 (^^^^)
(^^^^)
Уджобство понятия эксергии заключается в том, что с помощью эксергии можно рассматривать как отдельные процессы, так и циклы работ реальных тепловых машин.
Эксергетический баланс потерь позволяет рассматривать частичные потери аддитивно в цикле тепловой машины.
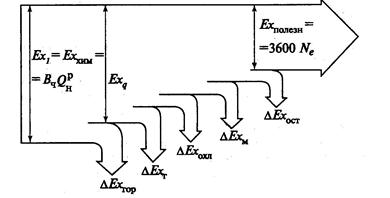
Рис. 3.25 Эксергетический баланс ДВС
Здесь: Ехполез –полезная работа цикла; ∆Ехост – остальные потери;
∆Ехм – потери от охлаждения в массло; ∆Ехохл – потери от охлаж-
дения цилиндра; ∆Ег - потери с уходящими газами; ∆Егор –потери
от несовершенства процесса сгорания.
3.4 СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
В технике часто приходится иметь дело с газообразными веществами, близкими посвойствам к идеальным газам представляющими механическую смесь отдельных газов. Наиболее ярким примером газовой смеси является воздух, представлящий смесь из азота, кислорода, углекислого газа, водяного пара и одноатомных газов. Поэтому для решения практических задач необходимо уметь определять основные параметры газовой смеси: газовую постоянную, среднюю молекулярную массу, теплоемкость и парциальные давления.
Газовая смесь идеальных газов подчиняется закону Дальтона, который гласит: общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
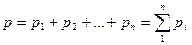
Здесь р1, р2....рn - парциальные давления.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, во всем объеме и при темпратуре смеси.
Смесь идеальных газов подчиняется уравнению Клапейрона – Менделеева:
pV=mRT
Газовая смесь может быть задана массовыми, объемными или мольными долями.
Массовой долей называется отношение массы каждгого газа к общей массе смеси:
gi=m1/m; g2 = m2/m; ….gn = mn/m,
где g1,g2 …gn – массовые доли, m1,m2…mn – масса каждого газа, m- масса смеси.
Сумма массовых долей смеси равна единице:
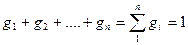
Сумма масс всех газов равна массе смеси:
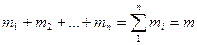
Объемной долей называется отношение парциального (приведенного) объема каждого газа к общему объему смеси газов:
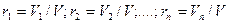
где r1, r2, …rn - объемные доли, V1,V2,…,Vn – парциальные (приведенные) объемы каждого газа; V – объем смеси газов.
Парциальным объемом газа называется объем, который занимал бы этот газ, если бы его температура и давление равнялись температуре и давлению смеси. Его можно определить, применяя закон Бойля – Мариотта. При постоянной температуре имеем:
V1=p1V/p; V2=p2V/p; …;Vn=pnV/p
Сложив уравнения, получим
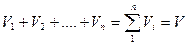
Сумма парциальных объемов газов, составляющих смесь, равна объему смеси.
Сумма объемных долей равна единице
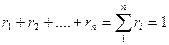
Задание смеси мольными долями равнозначно заданию ее объемными долями. Действительно, если мольной долей назвать отношение числа киломолей каждого газа Мi к числу киломолей смеси газов, то, учитывая, что
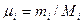 и
и 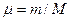 ,
,
можно написать
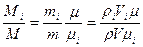
Из закона Авогадро при одинаковых давлениях и температуре 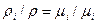 , что окончательно дает Mi/M = Vi/V=ri
, что окончательно дает Mi/M = Vi/V=ri
С о о т н о ш е н и е м е ж д у м а сс о в ы м и и о б ъ е м н ы м и д о л я м и. Между удельными объемами, пллотностями, молекулярными массами и газовыми постоянными какого-нибудь газа и смеси в целом на основании закона Авогадро и уравнения Клапейрона-Менделеева существует следующая связь
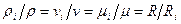 , где
, где
ρi – плотность каждого газа, ρ- плотность смеси; μi – молекулярная масса каждого газа; μ – молекулярная масса смеси газов.
Можно записать также
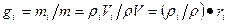 (*)
(*)
Из последних двух выражений можно составить несколько уравнений, связывающих массовые и объемные доли
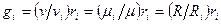 (**)
(**)
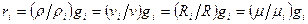 (***)
(***)
Газовая постоянная смеси газов.
Смесь газов подчиняется уравнению состояния
pV=mRT и R=pV/mT
Учитывая (***), 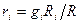 и
и 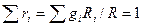
Откуда
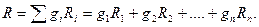
Газовая постоянная смеси газов равна сумме произведений массовых долей каждого газа на его газовую постоянную.
Можно определить газовую постоянную иначе
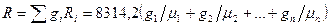 или по известной средней молекулярной массе смеси:
или по известной средней молекулярной массе смеси: 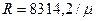
Если дан объемный состав смеси, то 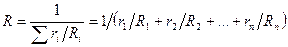
Средняя молекулярная масса смеси газов
3.5 ВОДЯНОЙ ПАР.
Основные понятия и определения.
Во всех областях промышленного производства получили большое применение пары различных веществ: воды, аммиака.углекислоты, фреонов и др. Из них наибольшее распространение получил водяной пар, являющийся рабочим телом в паровых турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменных аппаратах и т.п.
Процесс превращения вещества из жидкого состония в газообразное называется парообразованием. Испарением называется парообразование, которое происходит всегда при любой температуре со свободной поверхности жидкости или твердого тела. Испарение заключается в том, что отдельные молекулы с большими скоростями преодолевают притяжение соседних молекул и вылетают в окружающее пространство. Интенсивность испарения возрастает с ростом температуры жидкости.
Процесс кипения заключается в том, что если к жидкости подводить теплоту, то при некоторой температуре, зависящей от от физических свойств рабочего тела и давления, наступает процесс парообразования как на свободной поверхности, так и внутри ее.
Переход вещества из газообразного состояния в жидкое или твердое называется конденсацией. Процесс конденсации, так же как и процесс парообразования происходят при постоянной температуре, если при этом не меняется давление. Жидкость, полученная в результате конденсации пара, называется конденсатом.
Процесс перехода твердого вещества в газообразное называется сублимацией. Обратный процесс перехода пара в твердое вещество называется десублимацией.
Фазовая диаграмма для воды показана на рис.3.15
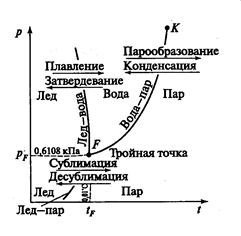
Рис.3.26 Фазовая диаграмма воды.
Если процесс парообразования происходит в неограниченном пространстве, то вся жидкость может превратиться в пар. Если же парообразование жидкости происходит в замкнутом пространстве, то вылетающие из жидкости молекулы заполняют свободное пространство над ней, при этом часть молекул, движущихся в паровом пространстве над поверхностью, возвращается обратно в жидкость. В некоторый момент между парообразованием и обратным переходом молекул из пара в жидкость может наступить равенство, при котором число молекул, вылетающих из жидкости равно числу молекул пара, возвратившихся в жидкость. В этот момент концентрации молекул пара над поверхностью жидкости максимальная. При этом имеется максимальная плотность пара при данной температуре, и пар называется насыщенным. При наличии мелкодисперсных частиц жидкости пар называют влажным. При дальнейшем подводе теплоты пар становится сухим насыщенным.
 2014-02-12
2014-02-12 601
601








