В приложениях к химическим и физико-химическим проблемам задача о движении электрона в потенциальном ящике с бесконечно высокими стенками получила название модели свободного электрона. Эта модель может быть использована для описания электронной структуры сопряжённых и ароматических углеводородов, для расчёта их электронных спектров поглощения, описания металлической связи, а также решения многих других задач. Следует отметить, что такой подход был особо популярен на ранних этапах развития квантовой химии. В настоящее время с появлением сравнительно точных квантово-химических методов и соответствующим развитием вычислительной техники он имеет лишь методологическое значение. Однако в целом ряде случаев в рамках данных модельных представлений оказывается возможным оценить на качественном уровне многие свойства достаточно сложных органических структур, используя лишь простые, подручные средства. Рассмотрим применение модели свободного электрона для описания электронных спектров поглощения сопряжённых углеводородов. Их типичными представителями являются линейные полиены, общей формулы 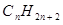 , для которых характерно чередование (альтернирование) одинарных и двойных связей. Особенностью структуры линейного полиена является цепочка связанных (сопряжённых) между собой атомов, вдоль которой движутся электроны, образующие π- электронную систему. При этом π- электроны «не привязаны» к какой либо паре углеродных атомов полиена, как это обычно бывает в случает σ- связи, а распределены по всем атомам, которые включены в π- электронную систему. В некоторых случаях σ- связи также могут иметь делокализованный характер, как например в диборане
, для которых характерно чередование (альтернирование) одинарных и двойных связей. Особенностью структуры линейного полиена является цепочка связанных (сопряжённых) между собой атомов, вдоль которой движутся электроны, образующие π- электронную систему. При этом π- электроны «не привязаны» к какой либо паре углеродных атомов полиена, как это обычно бывает в случает σ- связи, а распределены по всем атомам, которые включены в π- электронную систему. В некоторых случаях σ- связи также могут иметь делокализованный характер, как например в диборане 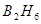 , где электроны локализованы на мостиковых σ- связях. Атомы водорода не принимают участия в образовании π- электронной системы, поскольку связаны с углеродом простой σ- связью. В связи с этим структуру сопряжённого углеводорода удобно оказывается в виде так называемого молекулярного графа. Вершины графа представляют углеродные атомы, а рёбра – соответствующие связи. В модели свободного электрона линейная цепочка атомов углерода рассматривается как одномерный потенциальный ящик, внутри которого находятся электроны. Соответствующий потенциал внутри ящика равен нулю, а за его пределами – бесконечности. Это в свою очередь означает, что π- электрон может находиться внутри ящика, но не может выйти за его пределы.
, где электроны локализованы на мостиковых σ- связях. Атомы водорода не принимают участия в образовании π- электронной системы, поскольку связаны с углеродом простой σ- связью. В связи с этим структуру сопряжённого углеводорода удобно оказывается в виде так называемого молекулярного графа. Вершины графа представляют углеродные атомы, а рёбра – соответствующие связи. В модели свободного электрона линейная цепочка атомов углерода рассматривается как одномерный потенциальный ящик, внутри которого находятся электроны. Соответствующий потенциал внутри ящика равен нулю, а за его пределами – бесконечности. Это в свою очередь означает, что π- электрон может находиться внутри ящика, но не может выйти за его пределы.
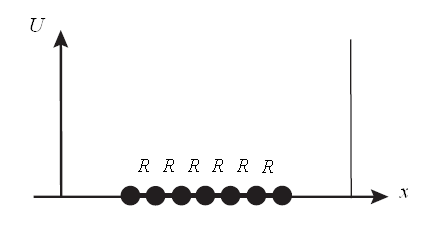
Рис.6. Потенциальный ящик для сопряжённого линейного полиена
в модели свободного электрона
Необходимо отметить, что в этой максимально упрощённой модели химической связи не рассматривается взаимодействие электрона с ядрами атомов. Движение электронов ограничено линейными размерами сопряжённой системы. Если число атомов углеводорода равно 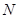 , то ширина потенциального ящика, очевидно, будет равна расстоянию между концевыми атомами:
, то ширина потенциального ящика, очевидно, будет равна расстоянию между концевыми атомами:
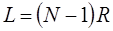
где 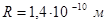 - длина
- длина  связи в сопряжённых системах. В модели свободного электрона, однако, предполагают, что электрон может выходить за пределы цепи сопряжения на некоторое расстояние. В простейшем случае ширину потенциального ящика принимают равно длине углеродной цепи, увеличенной на одно звено с каждого её конца:
связи в сопряжённых системах. В модели свободного электрона, однако, предполагают, что электрон может выходить за пределы цепи сопряжения на некоторое расстояние. В простейшем случае ширину потенциального ящика принимают равно длине углеродной цепи, увеличенной на одно звено с каждого её конца:
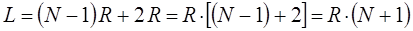
В сопряжённой системе каждый углеродный атом даёт в общую π- электронную систему по одному электрону. Электроны, в свою очередь, распределяются по соответствующим энергетическим уровням. При этом в силу принципа Паули на каждом энергетическом уровне могут располагаться не более чем по два электрона. Следовательно, в молекуле сопряжённого углеводорода, содержащей 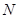 атомов углерода,
атомов углерода, 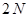 электронов должны расположиться на
электронов должны расположиться на 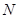 уровнях. Между тем на эти места есть только
уровнях. Между тем на эти места есть только 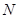 носителей заряда, для которых достаточно
носителей заряда, для которых достаточно 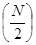 уровней и таким образом часть состояний, начиная с уровня
уровней и таким образом часть состояний, начиная с уровня 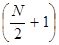 , остаются свободными.
, остаются свободными.
Энергия уровня выражается через массу электрона 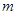 , ширину потенциального ящика
, ширину потенциального ящика 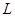 и квантовое число уровня
и квантовое число уровня 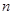 :
:
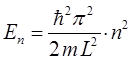
тогда энергия спектрального перехода 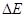 между уровнями
между уровнями 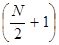 и
и 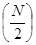 будет очевидно равна разности энергий соответствующих уровней. Учитывая, что:
будет очевидно равна разности энергий соответствующих уровней. Учитывая, что:
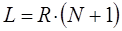
будем иметь соответственно:
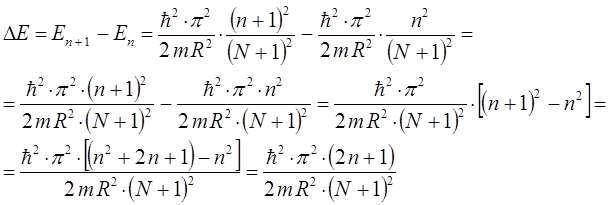
откуда следует, что:
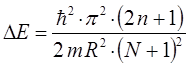
Учитывая, что в молекуле сопряжённого углеводорода, содержащей 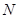 атомов углерода,
атомов углерода, 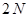 электронов должны располагаться на
электронов должны располагаться на 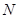 уровнях, в то время как на эти места есть только
уровнях, в то время как на эти места есть только 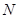 носителей заряда, для которых достаточно
носителей заряда, для которых достаточно 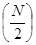 уровней, и таким образом часть состояний, начиная с уровня
уровней, и таким образом часть состояний, начиная с уровня 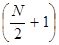 , остаются свободными. Тогда очевидно выражение определяющее энергию спектрального перехода между данными уровнями, можно будет далее записать в виде:
, остаются свободными. Тогда очевидно выражение определяющее энергию спектрального перехода между данными уровнями, можно будет далее записать в виде:
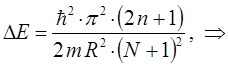
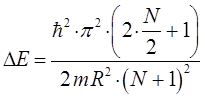
откуда соответственно:
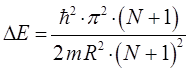
и таким образом:
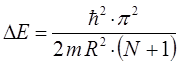
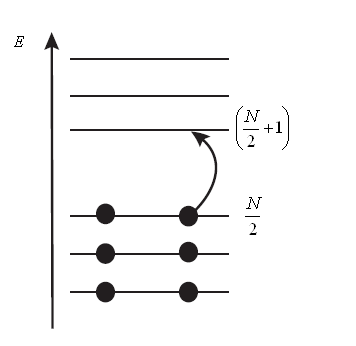
Рис.7. Схематическое описание перехода электрона между энергетическими уровнями в молекулах линейных полиенов
К полученному выше выражению можно также прийти и другим путём. Так, имеем выражение для энергии частицы, находящейся на 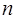 - м энергетическом уровне ящика:
- м энергетическом уровне ящика:
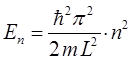
или с учётом:
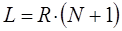
для энергии спектрального перехода  между уровнями
между уровнями 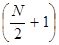 и
и 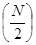 ,будем иметь для каждого из таких уровней:
,будем иметь для каждого из таких уровней:
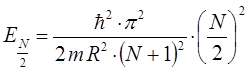
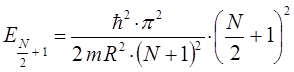
тогда, соответственно:
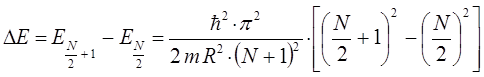
откуда следует, что:
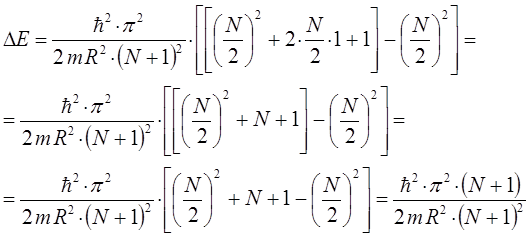
тогда будем иметь соответственно:
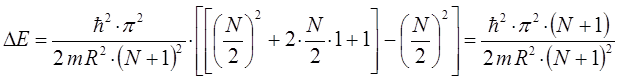
Таким образом, в ходе проделанных выше выкладок, мы приходим к соответствующему выражению вида:
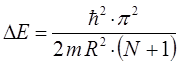
Используя условие частот Бора, можно получить выражение для волнового числа спектрального перехода. Так, имеем соответственно:
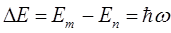
где
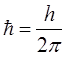
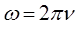
откуда следует:
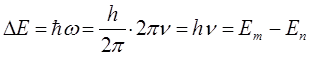
Учитывая, что:
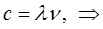
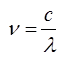
имеем после соответствующей подстановки в условие частот Бора:
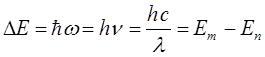
Очевидно, полученное выражение не изменится, если его правую (дробную) часть умножить и разделить на одно и то же число 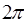 .
.
Выполнив в полученном выражении соответствующие преобразования, будем иметь соответственно:
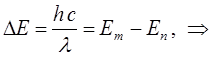
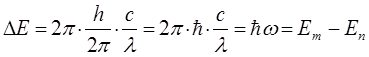
Не трудно заметить, что полученное выражение сводится к уравнению вида:
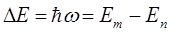
действительно, принимая во внимание выражения:
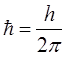
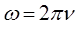
имеем:
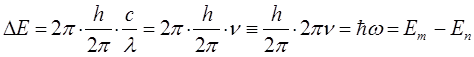
Итак, в ходе преобразований, мы пришли к выражению вида:
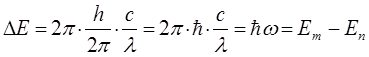
учитывая, что:
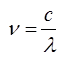
а также:
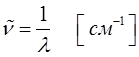
будем иметь соответственно:
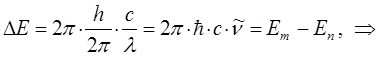
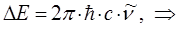
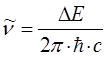
Ранее нами была уже получена формула, позволяющая вычислять энергию спектрального перехода частицы:
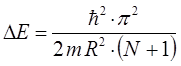
подстановка последней в соответствующее выражение для волнового числа 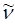 :
:
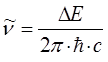
приводит к уравнению вида:
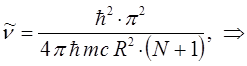
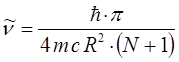
имеем таким образом:
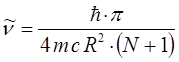
подставляя численные значения 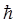 ,
, 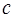 ,
, 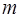 и длину
и длину 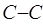 сопряжённой связи
сопряжённой связи 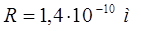 , получаем окончательную формулу для волнового числа (в см-1) как функцию числа углеродных атомов
, получаем окончательную формулу для волнового числа (в см-1) как функцию числа углеродных атомов 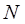 .
. 
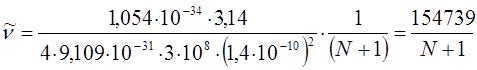
имеем, таким образом, соответственно:
Необходимо отметить, что при описании ароматических и более сложных молекул, пользуются двухмерной и трёхмерной моделями.
Таблица 1. Фундаментальные постоянные (СИ)
| Фундаментальные постоянные (СИ) | Обозначение постоянной (СИ) | Значение постоянной (СИ) | Размерность постоянной (СИ) |
| Постоянная Планка (оператор Дирака) | 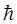 | 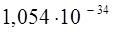 | 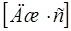 |
| Скорость света в вакууме | 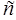 | 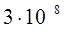 | 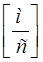 |
| Масса электрона | 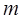 | 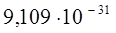 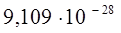 | 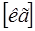  |
 2015-03-22
2015-03-22 1298
1298
