Как будет изменяться внутренняя энергия при различных термодинимических процессах?
Изучение первого закона термодинамики продолжает формирование представления десятиклассников о фундаментальном естественнонаучном принципе – принципе сохранения энергии. Открытие первого закона термодинамики было отнесено Ф. Энгельсом к числу трех крупнейших открытий XIX в., наряду с открытием клетки и созданием теории Дарвина. В школьном курсе физики первый закон термодинамики изучают как обобщение большого числа опытных данных, устанавливавших соотношение между количеством теплоты, получаемым за счет работы, и совершенной работой.
Прежде чем приступить к изучению первого закона термодинамики, целесообразно повторить закон сохранения энергии в механических процессах, при этом особое внимание уделяют обсуждению вопроса о том, что механическая энергия сохраняется в замкнутых консервативных системах. Если система не является консервативной, то ее механическая энергия не сохраняется, она частично или полностью превращается во внутреннюю энергию, но при этом сохраняется полная энергия системы.
Далее рассматривают, какими способами можно изменить внутреннюю энергию системы. Этот материал изучали в VIII классе, поэтому здесь его повторяют и обобщают. В результате школьников подводят к выводу: внутреннюю энергию можно изменить либо в процессе теплопередачи, либо при совершении работы, либо при совершении работы и при теплопередаче одновременно.
Обсуждают вопрос о мерах изменения внутренней энергии при том или ином процессе. Учащиеся делают вывод: мерой изменения внутренней энергии в процессе совершения работы является работа, а мерой изменения внутренней энергии в процессе теплопередачи – количество теплоты. Здесь же целесообразно повторить вопрос о знаках этих величин. Условились считать количество теплоты положительным (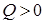 ), если тепло сообщается системе, а отрицательным (
), если тепло сообщается системе, а отрицательным (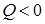 ), если количество теплоты отдано системой.
), если количество теплоты отдано системой.
Работу A, совершаемую внешними силами над системой, считают положительной (A>0), если газ сжимается; работа внешних сил отрицательна, если газ расширяется (A<0).
Рассмотрев ряд примеров, делают вывод: изменение внутренней энергии системы равно сумме количества теплоты, переданного системе, и работе внешних сил над системой: 
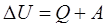
где 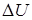 – изменение, внутренней энергии, равное разности значений внутренней энергии в конечном и в начальном состояниях. Эту формулу можно записать иначе:
– изменение, внутренней энергии, равное разности значений внутренней энергии в конечном и в начальном состояниях. Эту формулу можно записать иначе:
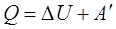
Количество теплоты, сообщенное системе, идет на увеличение ее внутренней энергии и на совершение системой работы над внешними телами.
Анализируя формулу первого закона термодинамики, целесообразно еще раз подчеркнуть, что внутренняя энергия характеризует состояние системы независимо от способа изменения этого состояния, так как внутренняя энергия системы однозначно определяется параметрами: объемом V и температурой Т. Работа и количество теплоты характеризуют процесс изменения состояния. При одинаковом изменении состояния эти величины различны (в зависимости от способа перехода системы из одного состояния в другое), хотя сумма их будет одна и та же.
После изучения первого закона термодинамики целесообразно разобрать со школьниками ряд упражнений на применение его к конкретным процессам. Например, описать энергетически: 1) теплообмен между телами в калориметре; 2) нагревание воды на спиртовке; 3) нагревание при ударе.
В первом случае система замкнутая и теплоизолированная (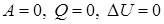 ), внутренняя энергия системы не изменяется. Во втором случае система замкнутая (
), внутренняя энергия системы не изменяется. Во втором случае система замкнутая (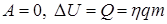 ), изменение внутренней энергии равно количеству теплоты. В третьем случае система теплоизолированная (
), изменение внутренней энергии равно количеству теплоты. В третьем случае система теплоизолированная (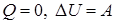 ); изменение внутренней энергии равно совершенной работе.
); изменение внутренней энергии равно совершенной работе.
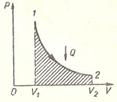 |
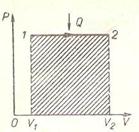 Рисунок 1. – Изобарный процесс Рисунок 1. – Изобарный процесс |
Далее целесообразно рассмотреть примеры применения первого закона термодинамики к изопроцессам в идеальных газах. При изобарном нагревании (рисунок 1) количество теплоты, переданное системе, идет на увеличение ее внутренней энергии и на совершение системой работы расширения при постоянном давлении. Работа расширения положительна (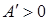 ) и равна
) и равна 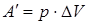 . На рисунке видно, что работа численно равна площади заштрихованного прямоугольника. Увеличение внутренней энергии при данном процессе равно:
. На рисунке видно, что работа численно равна площади заштрихованного прямоугольника. Увеличение внутренней энергии при данном процессе равно:
При изобарном охлаждении внутренняя энергия системы уменьшается. Количество теплоты, которое оно отдает, равно изменению внутренней энергии системы и работе по сжатию газа. В этом случае и количество теплоты, и работа системы отрицательны. Внутренняя энергия системы уменьшается.
Рисунок 2. – Изохорный процесс
При изохорном процессе (рисунок 2) работа равна нулю, так как объем газа не меняется ( ), поэтому изменение внутренней энергии равно количеству теплоты. При нагревании количество теплоты
), поэтому изменение внутренней энергии равно количеству теплоты. При нагревании количество теплоты 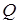 и изменение внутренней энергии
и изменение внутренней энергии 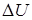 положительны, т. е. внутренняя энергия увеличивается, при охлаждении – внутренняя энергия уменьшается.
положительны, т. е. внутренняя энергия увеличивается, при охлаждении – внутренняя энергия уменьшается.
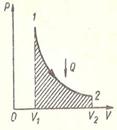
Рисунок 3. – Изотермический процесс
При изотермическом процессе (рисунок 3) температура постоянна, поэтому 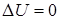 , т. е. внутренняя энергия не изменяется. Если система получает некоторое количество теплоты, то оно идет на работу, совершаемую газом при расширении. На рисунке работа численно равна площади заштрихованной фигуры. При изотермическом сжатии система отдает тепло:
, т. е. внутренняя энергия не изменяется. Если система получает некоторое количество теплоты, то оно идет на работу, совершаемую газом при расширении. На рисунке работа численно равна площади заштрихованной фигуры. При изотермическом сжатии система отдает тепло: 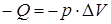 ,
, 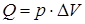 .
.
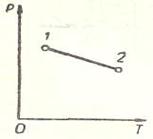
Рисунок 4. – Адиабатический процесс
При адиабатном процессе (рисунок 4) не происходит теплообмена с окружающей средой, поэтому количество теплоты 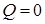 . Следовательно, внутренняя энергия изменяется только за счет совершения работы. При этом при расширении система совершает положительную работу
. Следовательно, внутренняя энергия изменяется только за счет совершения работы. При этом при расширении система совершает положительную работу 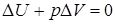 ,
, 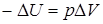 ; внутренняя энергия системы уменьшается.
; внутренняя энергия системы уменьшается.
При сжатии внешние силы совершают положительную работу, а газ –отрицательную; внутренняя энергия увеличивается, газ нагревается.Из графиков адиабатного и изотермического процессов, изображенных на (рисунке 3 и 4), видно, что при адиабатном расширении совершается работа меньшая, чем при изотермическом, а при адиабатном сжатии – большая, чем при изотермическом, Полезно также с учащимися решать графические задачи, требующие выяснения знаков величин, входящих в формулу первого закона термодинамики, например такую: на рисунке 5 изображен график зависимости давления идеального газа от температуры.
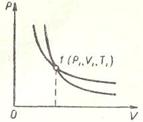
Рисунок 5. – Изотермический процессы
Как изменяется при этом изменении состояния газа его внутренняя энергия, совершается ли работа, получает или отдает система тепло?
При переходе газа из состояния 1в состояние 2давление уменьшается, температура, объем и внутренняя энергия газа увеличиваются. Объем газа увеличивается (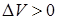 ), следовательно, газ совершает работу расширения, являющуюся положительной. Количество теплоты также положительно (
), следовательно, газ совершает работу расширения, являющуюся положительной. Количество теплоты также положительно (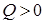 ), следовательно, газ получает некоторое количество теплоты.
), следовательно, газ получает некоторое количество теплоты.
Усвоению первого закона термодинамики способствует и решение вычислительных задач.
Рассмотрение применения первого начала термодинамики к изопроцессам создает основу для понимания десятиклассниками принципов работы тепловых двигателей.
 2015-03-22
2015-03-22 3135
3135
