- увеличение содержания неитрофилов в гемо
грамме свыше 65%. Наблюдается при острых
инфекционных заболеваниях, гнойных воспали
тельных процессах, инфаркте миокарда, укусах
ядовитых насекомых, после острой кровопоте-
ри, а также при алиментарном и эмоциональном
физиологических лейкоцитозах. Важное прак
тическое значение имеет определение степени
ядерного сдвига в лейкоцитарной формуле. По
этому признаку различают шесть видов нейтро-
фильного лейкоцитоза:
1) без ядерного сдвига - увеличение количества
зрелых сегментоядерных неитрофилов на фоне
общего лейкоцитоза;
2) с гипорегенеративным ядерным сдвигом влево - увеличение содержания палочкоядерных форм неитрофилов (свыше 5%) на фоне нейтро-филии; характерен для легкого течения ряда инфекций и воспалений;
3) с регенеративным ядерным сдвигом влево
- на фоне нейтрофилии и увеличенного содержа
ния палочкоядерных форм обнаруживаются ме-
тамиелоциты; общее количество лейкоцитов, как
правило, увеличено; характерен для гнойно-сеп
тических процессов;
4) с гиперрегенеративным ядерным сдвигом влево - характеризуется появлением в гемограмме еще более молодых форм лейкоцитов (миело-циты и даже отдельные промиелоциты и мие-лобласты), при этом эозинофилы часто вообще отсутствуют (анэозинофилия). Подобная картина является тревожным показателем, указывающим на неблагоприятное течение инфекционных и гнойно-септических заболеваний;
5) с дегенеративным ядерным сдвигом влево
- повышение содержания палочкоядерных неи
трофилов сопровождается появлением зна
чительного числа деструктивно измененных сег-
ментоядерных форм (пикноз ядер, токсогенная зернистость и вакуолизация цитоплазмы и т. д.). Дегенеративный ядерный сдвиг влево является показателем угнетения функциональной активности костного мозга и может иметь место при тяжелом течении инфекционных заболеваний, при эндогенной интоксикации и т. д.;
6) с дегенеративным ядерным сдвигом вправо - характеризуется появлением в гемограмме гиперсегментированных (свыше 5 сегментов) неитрофилов; отмечается при лучевой болезни, злокачественной анемии Аддисона - Бирмера, но в ряде случаев может обнаруживаться и у практически здоровых людей.
Эозинофилия - увеличение содержания эози-нофилов свыше 5%. По современным представлениям эозинофилия является своеобразной реакцией организма на поступление в него чужеродных белков и гистамина и связана с антитоксической и фагоцитарной14 функцией эози-нофилов.
Развитие эозинофилии имеет место при различных аллергических заболеваниях и синдромах (бронхиальная астма, отек Квинке, крапивница и др.); при паразитарных заболеваниях (описторхоз, аскаридоз, лямблиоз и др.), некоторых кожных болезнях (псориаз, экзема), кол-лагенозах (ревматизм, дерматомиозит), гемобла-стозах (хронический миелолейкоз, лимфогранулематоз), некоторых эндокринопатиях (гипофи-зарная кахексия, микседема и др.), ряде инфекционных заболеваний (скарлатина, сифилис, туберкулез), при применении некоторых лекарственных препаратов (антибиотики, сульфаниламиды и др.); описаны также наследственные формы эозинофилии.
Базофилия - редкая форма лейкоцитоза, встречающаяся при хроническом миелолейкозе, гемолитических анемиях, гемофилии, а также при вакцинациях и введении в организм чужеродного белка.
Лимфоцитоз - увеличение содержания лимфоцитов свыше 45%. Физиологический лимфоцитоз характерен для детей первых 10 лет жизни, а также отмечается у вегетарианцев и после физических нагрузок (миогенный). В условиях патологии лимфоцитоз развивается при ряде инфекционных заболеваний (брюшной тиф, свин-
и Основным объектом фагоцитоза эозинофилов являются не микробы и не бактериальные частицы, а иммунный комплекс антиген - антитело.
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
коклюш, малярия, бруцеллез, инфекцион-
юнонуклеоз, туберкулез, сифилис и др.), а
е при алиментарной дистрофии, бронхиаль-
астме и некоторых эндокринных расстрой-
(евнухоидизм, микседема, акромегалия).
1оноцитоз - увеличение числа моноцитов
t 9%, является показателем развития в
взме иммунных процессов; характерен для
о ряда острых инфекционных и вирусных
ваний (оспа, корь, свинка, краснуха, диф-
зкгия и др.).
13.4.3. Лейкемоидные реакции
[ейкемоидные реакции - патологические
аии системы крови, характеризующиеся
зениями в периферической крови (увеличе-
: общего количества лейкоцитов до 30 • 109/л и
к, появлением незрелых форм лейкоцитов),
еяыми с таковыми при лейкозах и исчезаю-
зси после купирования вызвавшего их пер-
iro процесса. Выделяют две большие груп-
гейкемоидных реакций: миелоидного типа
лимфатического (моноцитарно-лимфатичес-
) типа. В свою очередь, лейкемоидные ре-
"ттелоидного типа подразделяют на реак-
с картиной крови, соответствующей тако-
ipu хроническом миелолейкозе(при инфек-
=но-воспал и тельных заболеваниях,
хсикациях, лимфогранулематозе и др.), и
называемые большие эозинофилии крови
паразитарных инвазиях, аллергических
"еваниях, коллагенозах и др.). Среди лей-
пидных реакций лимфатического типа наи-
е важной в практическом отношении явля-
i моноцитолимфатическая реакция крови при
■щионном мононуклеозе, при которой в пе-
црической крови обнаруживаются атипичные
■вуклеары («лимфомоноциты»), сходные по
|юлогии с бластными клетками.
13.4.4. Лейкопении
Лейкопения - уменьшение общего количества
социтов ниже 4 • 10 9/л. Наиболее часто раз-
:е лейкопении связано с уменьшением абсо-
юго числа нейтрофилов (нейтропения). Лим-
топения может иметь место при лимфогра-
гозе, пневмонии, сепсисе, коллагенозах
воторых других заболеваниях, но редко явля-
i причиной лейкопении. Моноцитопения,
зопения хотя и имеют существенное диаг-
ностическое значение, но не отражаются на общем количестве лейкоцитов.
В основе патогенеза лейкопении (нейтропе-нии) лежат три механизма: 1) угнетение лейко-поэтической функции костного мозга с нарушением продукции лейкоцитов, их созревания и выхода в периферическую кровь; 2) повышенное разрушение клеток в сосудистом русле; 3) перераспределение лейкоцитов в сосудистом русле, задержка их в органах-депо.
Нейтропении, обусловленные уменьшением продукции нейтрофилов в костном мозге. Развитие их связано прежде всего с нарушением пролиферации, дифференцировки и созревания стволовых гемопоэтических клеток (при миелоток-сическом и иммунном воздействии различных токсических веществ и лекарственных препаратов), в случаях выпадения стимулирующей диф-ференцировку стволовых клеток функции Т-лимфоцитов, а также при «внутреннем» дефекте клеток-предшественниц гранулоцитопоэза -потере способности их к дифференцировке в клетки нейтрофильного ряда при сохраняющейся способности к нормальной дифференцировке в эози-нофильные, базофильные и моноцитарные клетки. К снижению костномозговой продукции нейтрофилов приводят также уменьшение плацдарма гранулоцитопоэза из-за вытеснения гемопоэтических клеток опухолевыми клетками при лейкозах и карцинозах (метастазах рака в костный мозг), дефицит различных веществ, необходимых для пролиферации, дифференцировки и созревания кроветворных клеток (белки, аминокислоты, витамины В12, фолиевая кислота и др.), патология клеток, образующих гемопоэтические факторы роста и цитокины (ГМ-КСФ, Г-КСФ, ИЛ-3, М-КСФ и др.), и ряд других причин.
Нейтропении, обусловленные интенсивным разрушением нейтрофилов. Разрушение нейтрофилов может происходить под влиянием антител типа лейко-агглютининов, которые образуются при переливании крови (особенно лейкоцитарной массы), под влиянием некоторых лекарственных препаратов, являющихся аллергенами-гаптенами (сульфаниламиды, амидопирин и др.), при заболеваниях, сопровождающихся увеличением количества циркулирующих в крови иммунных комплексов (аутоиммунные заболевания, лимфо-мы, опухоли, лейкозы и др.), при действии токсических факторов инфекционного происхожде-
вва 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
ния (тяжелые инфекционные заболевания, обширные воспалительные процессы). Нейтропе-ния может развиваться вследствие повышенного разрушения неитрофилов в селезенке при заболеваниях, сопровождающихся гиперсплениз-мом (коллагенозы, цирроз печени, гемолитическая анемия, болезнь Фелти и др.).
Нейтропения, связанная с перераспределением неитрофилов внутри сосудистого русла. Наблюдается при шоке, неврозах, острой малярии и некоторых других состояниях в результате скопления клеток в расширенных капиллярах органов-депо (легкие, печень, кишечник). Перераспределительная нейтропения имеет временный характер и, как правило, сменяется лейкоцитозом.
Агранулоцитоз - клинико-гематологический синдром, характеризующийся полным или почти полным отсутствием нейтрофильных грану-лоцитов в крови. Условно за агранулоцитоз принимают состояние, при котором уровень грану-лоцитов ниже 0,75 • 109/л и/или общее количество лейкоцитов менее 1 • 109/л.
Наиболее часто развитие агранулоцитоза связано с приемом медикаментов (цитостатические препараты, амидопирин, аминазин, антитирео-идные средства, сульфаниламиды, некоторые антибиотики и др.). Во многих случаях этиологические факторы, приводящие к возникновению тяжелой гранулоцитопении, остаются неустановленными («генуинные», или идиопати-ческие агранулоциозы).
По механизму развития агранулоцитозы подразделяют на миелотоксический и иммунный. В основе миелотоксического агранулоцитоза лежит угнетающее действие медикаментозных препаратов и других повреждающих факторов на пролиферативную активность гранулоцитар-ных элементов костного мозга, вследствие чего развивается гипоплазия гранулоцитопоэза; возможность возникновения тяжелой гранулоцитопении при этом определяется суммарной дозой принятого препарата. Миелотоксический агранулоцитоз обычно сочетается с анемией и тром-боцитопенией.
Ведущее значение в патогенезе иммунных (гаптеновых) агранулоцитозов имеет появление в организме антител (агглютинины, лизины и г.д.), действие которых направлено против собственных лейкоцитов периферической крови, "читается, что медикаментозные препараты вы-
ступают в роли гаптенов, образующих комплексные соединения с белками плазмы и мембран лейкоцитов. Вырабатываемые на образовавшийся «чужеродный» комплекс (антиген) антитела, фиксируясь на поверхности лейкоцитов, вызывают их разрушение. Как правило, при иммунном агранулоцитозе снижается содержание только лейкоцитов.
Классическим клиническим проявлением агранулоцитоза независимо от причин и механизмов его развития является язвенно-некротическая ангина (angina agranulocytotica), развивающаяся вследствие подавления защитных реакций организма (снижения резистентности к бактериальной флоре).
13.4.5. Лейкозы
Лейкозы - опухоль, исходящая из родоначаль-ных (стволовых) кроветворных клеток с первичным поражением костного мозга.
В отличие от лейкоцитозов, лейкемоидных реакций и других реактивных разрастаний кроветворной ткани в основе лейкозов лежит неконтролируемая (безграничная) пролиферация клеток с нарушением способности их к диф-ференцировке и созреванию. Утратившие способность к созреванию лейкозные клетки могут проходить значительно большее, чем нормальные клетки крови, число циклов деления, что и создает огромную клеточную продукцию, характеризующую лейкоз.
Этиология лейкозов до настоящего времени точно не установлена. Об опухолевой природе лейкозов свидетельствует наличие общих закономерностей, объединяющих лейкозы и опухоли: нарушение способности клеток к дифферен-цировке; морфологическая и метаболическая анаплазия клеток; общие этиологические факторы, способствующие развитию лейкозов и опухолей, и др.
К возможным этиологическим факторам, вызывающим развитие лейкозов, относят ионизирующую радиацию, ряд химических веществ, вирусы. Определенное значение в развитии лейкозов придается генетическим факторам, наследственной и приобретенной иммунной недостаточности, действию бластомогенных метаболитов триптофана и тирозина.
Соответственно существует несколько теорий происхождения лейкозов.
Радиационная теория. Роль ионизирующих излучений в возникновении
(22
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
лейкозов доказана в эксперименте. Как однократное (в дозе 2 Гр и выше), так и хроническое (в течение 2-3 мес) облучение лучами Рентгена в малых дозах могут индуцировать лейкоз у лабораторных животных (крысы, мыши). Прослежено повышение заболеваемости острым и хроническим миелолеикозом у жителей Хиросимы и Нагасаки, у рентгенологов и радиологов. Приводятся данные об увеличении частоты лейкозов у больных, леченных большими дозами лучей Рентгена, иттрия, радия по поводу злокачественных новообразований и анкилозирующего спондилоартрита, а также у детей, получавших облучение вилочковой железы в раннем возрасте, и др. Описано учащение случаев острых лейкозов среди больных эритремией после лечения их радиоактивным фосфором.
Теория химического лейкозо-г е н е з а. Экспериментально доказана возможность индуцирования лейкозов у животных введением канцерогенных веществ (диметилбен-зантрацен, метилхолантрен и др.). Также в эксперименте показана возможность стимуляции лейкозогенеза метаболитами триптофана и тирозина (М.Л. Раушенбах). Однако роль этих веществ в лейкозогенезе человека не доказана. В то же время накоплены данные, указывающие на увеличение риска заболевания лейкозами (как правило, острыми) у людей, имеющих длительный профессиональный контакт с бензолом и летучими органическими растворителями (шоферы, работники кожевенной и обувной промышленности и т.д.). В последние годы отмечено заметное учащение случаев острого лейкоза у больных злокачественными новообразованиями, леченных такими цитостатическими препаратами, как циклосфосфан, хлорбутин, метотрексат, ми-елосан, адриамицин и др. К лекарственным препаратам, способным индуцировать лейкозы, относятся также бутадион, левомицетин и некоторые другие.
Вирусная теория связывает возникновение лейкозов с активацией (под действием радиации и химических факторов) латентных лей-козогенных вирусов. Несомненно доказанным является вирусное происхождение лейкозов у многих видов животных - птиц, мышей, крыс, хомячков, кошек, крупного рогатого скота. К настоящему времени выделено и детально охарактеризовано несколько типов вирусов, вызывающих различные виды лейкозов у животных. Как правило, это РНК-содержащие вирусы, а
также ДНК-содержащие вирусы, которые относятся к герпес-вирусам (подробнее см. гл. 12).
Вопрос о роли вирусов в происхождении лейкозов у человека остается во многом спорным. Против вирусной этиологии лейкозов у человека говорит прежде всего факт невозможности прямой перевивки лейкозов при случайном переливании крови лиц, больных лейкозом, и отсутствие убедительных доказательств контаги-озности лейкозов. Не описаны также случаи передачи лейкоза от больной матери плоду и новорожденному в период вскармливания грудью.
Генетическая теория располагает достаточно убедительными аргументами, указывающими на возможность наследственного предрасположения к лейкозам. Известны случаи семейных лейкозов, доказана роль этнических особенностей в развитии лимфолейкоза. К возникновению лейкозов предрасполагают болезни, характеризующиеся спонтанными разрывами хромосом и нерасхождением соматических или половых хромосом (болезнь Дауна, анемия Фанко-ни, синдромы Кляйнфелтера, Тернера и др.). Получены линии мышей, у которых частота спонтанных лейкозов близка к 100%.
Патогенез лейкозов. Согласно мутационно-клоновой теории происхождения лейкозов лей-козогенный фактор (ионизирующая радиация, химическое вещество, вирус и др.) вызывает мутацию (повреждение ДНК, нарушение генетического кода) одной из клеток-предшественниц гемопоэза II-III классов. В результате нарушается информация деления и дифференциров-ки клеток, наблюдается выход их из-под контроля регулирующих систем организма. Это приводит к безудержному размножению определенной разновидности клеток. Таким образом, составляющие субстрат опухоли лейкозные клетки представляют собой моноклональное потомство первоначально мутировавшей клетки и сохраняют все присущие ей признаки. В монокло-новой стадии опухолевые клетки чувствительны к химиотерапии.
В пользу клоновой природы лейкозов приводятся следующие факты: возможность перевивки лейкоза мышам путем введения одной лей-козной клетки; продукция гомогенного иммуноглобулина при миеломной болезни и макрогло-булинемии Вальденстрема; однотипность лейкоз-ных клеток (несущих на поверхности иммуноглобулины одного класса и подкласса) при хроническом лимфолейкозе; наличие специфичес-
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
Рис. 122. Аномальная (Ph'-) хромосома в клетке
больного хроническим миелолейкозом; большая
часть длинного плеча хромосомы отсутствует
ких хромосомных изменений в опухолевых клетках (например, кольцевые хромосомы как маркер радиационного поражения) при острых лейкозах, которые возникли у больных эритре-мией, леченных радиоактивным фосфором, и др.
Убедительным подтверждением клонового происхождения лейкозов является обнаружение у подавляющего большинства больных хроническим миелолейкозом (в 80-90% случаев) аномальной (с укороченным длинным плечом) так называемой филадельфийской (Ph') хромосомы во всех миелоидных клетках, включая грануло-цитарный, эритроидный и мегакариоцитарный ростки (рис. 122), возможно за исключением Т-лимфоцитов15. Этот факт яляется неоспоримым доказательством происхождения хронического миелолейкоза из одного патологического клона, родоначальницей которого является плюрипотен-тная стволовая клетка-предшественница миело-поэза (КОЕ-ГЭММ) (см. рис. 118, вклейка).
В процессе развития лейкоза (опухолевая прогрессия) происходят качественные изменения составляющих субстрат опухоли клеток, обусловленные нестабильностью их генетического аппарата. Деятельность последнего, в свою очередь, подвергается изменениям под влиянием нарушающегося состава хромосом (изменения структуры, появление анэуплоидии) и эпи-
15 Отсутствие Ph'-хромосомы и ее генетического эквивалента реаранжировки гена ber и протоонкогена аЫ может быть объяснено появлением этих долгоживущих клеток до момента опухолевой трансформации.
геномных, т. е. не связанных с изменением структуры генов, нарушений - переходом части ранее неактивных в клетке генов в активное состояние (феномен дерепрессирования генов). Эти изменения опухолевых клеток ведут к появлению новых клонов. В результате развивается поли-клоновость, опухоль становится злокачественной. Отдельные клоны опухолевых клеток выходят из-под контроля регулирующих систем организма, становятся устойчивыми к проводящейся цитостатической терапии, метастазируют в органы и ткани в норме в гемопоэзе не участвующие, образуя очаги экстрамедуллярного кроветворения.
Классификация лейкозов, особенности кроветворения и клеточного состава периферической крови при различных видах лейкозов
По патогенетическому принципу, исходя из особенностей морфологической характеристики лейкозных клеток, лейкозы подразделяют на острые и хронические. К острым лейкозам относят опухоли с полной остановкой дифферен-цировки родоначальных кроветворных клеток на каком-то уровне созревания; субстрат опухоли составляют клетки II, III и IV классов по современной схеме кроветворения. В группу хронических лейкозов входят опухоли с частичной задержкой созревания клеток и накоплением клеток определенной степени зрелости.
Острые лейкозы. Гематологическая картина в развернутой стадии заболевания характеризуется классической триадой - изменением содержания лейкоцитов (общее число лейкоцитов снижено, повышено или остается нормальным), появлением в крови большого числа бластных клеток и так называемым лейкемическим зиянием (hiatus leukaemicus), когда в периферической крови преобладают бластные клетки, имеется небольшой процент зрелых лейкоцитов и практически отсутствуют промежуточные формы созревания. Уже на ранних стадиях болезни отмечаются нормохромная анемия и тромбоцитопе-ния, развитие которых обусловлено угнетением нормального гемопоэза вследствие лейкемичес-кой трансформации кроветворения.
Составляющие субстрат опухоли бластные клетки при различных вариантах острого лейкоза морфологически трудно различимы, но мо-
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Таблица 59 Цитохимическая характеристика различных форм острого лейкоза (по Воробьеву А. И., Лорие Ю. И., 1977)
| Лейкоз | Перок-сидаза | Реакция с Суданом черным (на липиды) | Кислая фосфатаза | PAS-реакция (на гликоген) | а-Нафтил-эстераза | Хлорацетат эстераза | Реакция на кислые сульфати-рованные мукополи-сахариды |
| Лимфобластный | Нет | Нет | В отдельных клетках | Есть, в виде глыбок | Нет | Нет | Нет |
| Миело-бластный | Высокая | Высокая | Есть | Есть, в диффузном виде | Слабая | Высокая | Слабая, в отдельных клетках |
| МОно-бластный | Слабая | Слабая | Высокая | Слабая, диффузная | Высокая, подавляется фторидом натрия | Слабая | Нет |
| Промиело-цитарный | Очень высокая | Высокая | Есть | Очень высокая | Слабая | Очень высокая | Очень высокая |
| Эритро-миелоз | Реакции е сят от пр которые п ми, моноб руемыми ми | i бластных клб 1ИРОДЫ ЭТИХ С югут быть ми(ластами, неди бластами, эри | !тках зави-'лементов,!Лобласта-уференци-гробласта- | Может быть и в эритроб-ластах, и в эритроцитах, диффузная или в виде гранул | |||
| Недиффе-ренцируе-мый | Нет | Нет | Нет | Нет | Нет | Нет | Нет |
гут быть дифференцированы с помощью цитохимических методов по разнице в содержании ферментов. Исходя из особенностей цитохимических свойств лейкозных клеток, в большинстве современных классификаций острые лейкозы подразделяют на миелобластный, лимфобластный, промиелоцитарный16, монобластный, эритромиелоз, мегакариобластный и недифференцированный (табл. 59). Выделенные нозологические формы различаются также по клиническим признакам и, что особенно важно, по ответу на цитостатическую медикаментозную терапию. У взрослых больных чаще встречаются миелобластный и лимфобластный, у детей -лимфобластный и (реже) недифференцированный варианты острого лейкоза. В клинической прак-
1в Термин «острый промиелоцитарный лейкоз» в значительной мере является условным, поскольку опухоль состоит не из промиелоцитов, а из атипичных бластных клеток (миелобластов), цитоплазма которых богата крупной зернистостью.
тике руководствуются классификацией, разработанной специалистами Франции, США, Великобритании, - FAB (ФАБ)-классификацией (табл. 60).
Острый миелобластный лейкоз. Представляет собой опухоль, исходящую из клетки-предшественницы миелопоэза и состоящую преимущественно из родоначальных клеток гра-нулоцитарного ряда - миелобластов.
Острый недифференцированный лейкоз. Морфологический субстрат опухоли представлен клетками II - III классов по современной схеме кроветворения; морфологически они напоминают лимфобласты, но отличаются цитохимической интактностью.
Окончательный диагноз острого лейкоза (особенно в тех случаях, когда лейкемические клетки не выходят в периферическую кровь) должен ставиться на основании исследования пун-ктата костного мозга. При этом основным диагностическим признаком является мономорфная
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
ФАБ-классификация острых лейкозов
Таблица 60
| Обозначение варианта | Наименование |
| Острые нелимфобластные лейкозы | |
| м, м2 м3 м. .Зпл м4 м5а м5„ ме о м7 | Недифференцированный лейкоз (минимально дифференцированный острый миелобластныи лейкоз Миелобластныи лейкоз без признаков созревания клеток Миелобластныи лейкоз с признаками созревания клеток Промиелоцитарный лейкоз Микрогранулярный промиелоцитарный лейкоз Миеломонобластный лейкоз Монобластный лейкоз без признаков созревания клеток Монобластный лейкоз с признаками созревания клеток Эритромиелоз Мегакариобластный лейкоз |
| Острые лимфобластные лейкозы | |
| л, л2 л3 | Микролимфобластный лейкоз Лимфобластный лейкоз с типичными лимфобластами Макро- или пролимфобластный лейкоз |
картина костного мозга с преобладанием однотипных властных клеток. Морфологические критерии последних очень изменчивы; как и все опухолевые клетки, лейкемические бласты атипичны, отличаются прогрессирующей анаплазией. По мере прогрессирования заболевания вследствие опухолевой прогрессии и под влиянием цитостатической терапии бластные клетки могут до неузнаваемости изменять свою морфологию, утрачивать ферментную специфичность.
Острый лимфобластный лейкоз. Это опухоль, возникающая из клетки-предшественницы лимфопоэза.
Внедрение иммунологических методов в лей-козологию позволило получить уникальную информацию, касающуюся фенотипического разнообразия лейкемических лимфобластов и создать гистогенетически обоснованную классификацию острого лимфобластного лейкоза (ОЛЛ).
В 1995 г. Европейской группой по иммунологической характеристике лейкозов (European Group for the immunological characterisation of leikemias, EGIL) была предложена иммунологическая классификация ОЛЛ. В соответствии с этой классификацией выделяют 4 варианта Т-ОЛЛ, которые отличаются экспрессией в цитоплазме или на мембране клеток СДЗ-антигена, и 4 варианта ОЛЛ В-линии, базирующиеся на анализе экспрессии линейно-неспецифического маркера CD10 (common-ОЛЛ) и cyt JgM/mJgM (пре-(3 и р-ОЛЛ) (табл. 61).
У 50% взрослых больных с острым миелобластныи лейкозом и у 80% детей с острым лимфобластный лейкозом обнаруживаются бластные клетки с аномальным кариотипом (анэуплоидия, изменения структуры хромосом).
Хронические лейкозы. Несколько упрощенно классификацию хронических лейкозов можно представить в следующем виде: хронический миелолейкоз, хронический моноцитарный лейкоз, эритремия, хронический лимфолейкоз, ми-еломная болезнь, макроглобулинемия Вальден-стрема.
Хронический миелолейкоз. Одно из самых частых заболеваний в группе лейкозов; опухоль, исходящая из клетки-предшественницы миелопоэза. Морфологическим субстратом хронического миелолейкоза являются зрелые и созревающие клетки гранулоцитарного ростка кроветворения. В типичном случае (наличие Ph'-хромосомы в кроветворных клетках костного мозга) развернутая стадия характеризуется ней-трофильным лейкоцитозом с выраженным ядерным сдвигом влево: обнаруживаются единичные миелобласты, промиелоциты, миелоциты, мета-миелоциты, палочко- и сегментоядерные формы гранулоцитов. Как правило, развивается гипер-тромбоцитоз. У детей чаще наблюдается ювениль-ная (Ph'-негативная) форма хронического миелолейкоза, характеризующаяся высоким моно-цитозом и тромбоцитопенией. Весьма частым признаком хронического миелолейкоза, особен-
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Таблица 61 Иммунологическая классификация острого лимфобластного лейкоза [EGIL, 1995]
Фор м а
Название
Специфический маркер
Т-ОЛЛ _____ Для всех форм Т-ОЛЛ характерно наличие СДЗ+ мембранного или цитоплаз матического
Т-11Про-Т-ОЛЛICD7+ ___________
T-II __________________ Пре-Т-ОЛЛ _______________________ CD2+ и/или CD5+ и/или CD8+ __________
T-III ______________ Кортикальный Т-ОЛЛ ______________________________ CD1+ ___________________
T-IV Зрелый Т-ОЛЛ CD3+мембранный
__________________________________________________________________ СР1а- ___________________
В-ОЛЛ Для всех форм В-ОЛЛ характерно наличие CD19+ и/или CD79a и/или
CD 22+цитоплазматического
B-I __________________ Про-В-ОЛЛ ______________________ Нет экспрессии других маркеров _________
В-Н _________________ Common-ОЛЛ ________________________________ CD10+ __________________
В- IN__________________ Пре-В-ОЛЛ _________________________ Цитоплазматический JgM+ ___________
В IV Зрелый В-ОЛЛ Цитоплазматические или поверхностные
цепи Jg (каппа+ или лямбда+)
но у детей, является увеличение числа базофи-лов и эозинофилов (базофильно-эозинофильная ассоциация). Важным диагностическим признаком заболевания является увеличение селезенки и печени, что связано с лейкозной инфильтрацией и появлением очагов миелоидного кроветворения в этих органах.
Развернутая стадия хронического миело-лейкоза закономерно переходит в терминальную фазу, характеризующуюся так называемым «бластным кризом» (появление в костном мозге и в периферической крови значительного числа бластных клеток), прогрессирующей цитопе-нией (анемия, лейко-и тромбоцитопения), возникновением лейкемических инфильтратов в коже, лимфоузлах, миокарде и других органах. При кариологическом исследовании выявляется поликлоновость патологических клеток (анэуплоидия), которая является основным признаком терминальной стадии - новым этапом опухолевой прогрессии.
Хронический лимфолейкоз. Это опухоль иммунокомпетентной ткани, состоящая преимущественно из зрелых лимфоцитов, представленных в большинстве случаев В-клетками". Характерен лейкоцитоз; в мазках крови преобладают зрелые узкоцитоплазменные лимфоциты, содержание которых может доходить до 80% и более. Важным признаком служит появление теней Гумпрехта (раздавленные при приготовлении мазков неполноценные лимфоциты). Ко-
17 Хронический лейкоз, представленный Т-лимфоцита-ми, встречается приблизительно в 5% случаев.
личество лимфоцитов в костном мозге составляет не менее 50% всех миелокариоцитов. Разрастание лимфоидной ткани имеет место в лимфатических узлах, селезенке и печени, что сопровождается увеличением указанных органов.
Функциональная неполноценность образующих опухоль лимфоцитов приводит к нарушению иммунологического гомеостаза у больных, что, в свою очередь, становится причиной аутоиммунных конфликтов (аутоиммунные гемолитические анемии и тромбоцитопении); инфекционных осложнений (вследствие нарушения антителообразования) и т.д.
В отличие от хронического миелолейкоза властные кризы наблюдаются крайне редко, не развивается также вторичной резистентности к ци-тостатическим препаратам.
Эритремия (истинная полицитемия, болезнь Вакеза). Заболевание опухолевой природы, характеризующееся относительно доброкачественным течением. Источником роста опухоли является клетка-предшественница миело-поэза, основной субстрат опухоли - эритроциты. Наиболее характерны изменения со стороны периферической крови: количество эритроцитов достигает (6-12)* 10,2/л, уровень гемоглобина -160-200 г/л, показатель гематокрита увеличивается до 60-80%. Уровень эритропоэтина в крови и моче в отличие от симптоматических эритро-цитозов понижен. Имеются лейко- и тромбоцитов, уменьшается СОЭ, возрастает вязкость крови. Важным диагностическим признаком является увеличение массы циркулирующих эритроцитов.
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
Миеломная болезнь (плазмоци-т о м а). Макроглобулинемия Вальденстрема. Заболевания из группы парапротеинемических ге-мобластозов - опухолей из иммунокомпетентных клеток (плазматические и В-лимфоциты), синтезирующих гомогенные (моноклональные) иммуноглобулины (см. раздел 13.6.3).
Общие нарушения в организме при лейкозах проявляются в виде ряда синдромов: анемического, геморрагического, инфекционного, метастатического и интоксикационного.
Анемический синдром. Связан с угнетением эритроидного ростка костного мозга.
Геморрагический синдром (кровотечения из десен, носа, кишечника; возможны кровоизлияния в жизненно важные органы). Обусловлен снижением продукции тромбоцитов.
Инфекционный синдром. Причиной его является функциональная неполноценность лейкемических лейкоцитов (снижение способности к фагоцитозу, нарушение ферментного гомеостаза, угнетение синтеза антител в лимфоцитах и т.д.,}.
Метастатический синдром. Проявляется нарушением функций различных органов и систем вследствие появления в них лейкемических инфильтратов.
Интоксикационный синдром. Связан с наводнением организма нуклеопротеи-дами - токсическими продуктами, образующимися при распаде (гибели) лейкемических клеток.
Используемые в терапии лейкозов цитоста-тические лекарственные препараты могут вызвать целый комплекс побочных эффектов со стороны нормальных органов и систем организма, объединенных термином «цитостатическая болезнь». Особенно высокую чувствительность к токсическому действию противолейкозных препаратов проявляют нормальные быстро обновляющиеся клеточные системы: костный мозг, лимфоидные органы, эпителий желудочно-кишечного тракта, кожа, волосяные фолликулы, активно пролиферирующие ткани репродуктивных органов. В связи с этим под влиянием применяемой терапии клинические и морфологические проявления того или иного вида лейкоза могут существенно изменяться.
Причинами смерти при лейкозах являются резкое малокровие и тяжелая общая интоксика-
ция, поражение жизненно важных органов (лей-козная инфильтрация, обширные кровоизлияния). Непосредственной причиной смерти больных могут стать инфекционные осложнения (пневмонии, сепсис, перитонит).
13.5. ПАТОЛОГИЯ СИСТЕМЫ ГЕМОСТАЗА. ГЕМОРРАГИЧЕСКИЕ ДИАТЕЗЫ И СИНДРОМЫ. ТРОМБОФИЛИИ
Система гемостаза - совокупность биологических и биохимических механизмов, которые, с одной стороны, участвуют в поддержании целостности кровеносных сосудов и сохранении жидкого состояния циркулирующей крови, а с другой - обеспечивают быструю закупорку поврежденных сосудов и купирование кровотечений. От функционирования этой системы в значительной степени зависят состояние микроциркуляции крови в органах и тканях и уровень их кровоснабжения. В случае же патологических нарушений в этой системе появляется предрасположенность либо к кровоточивости, либо к развитию тромбозов сосудов, ишемий и инфарктов органов.
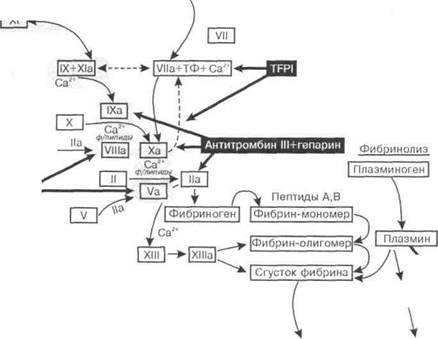
Осуществляется гемостаз тремя взаимодействующими между собой морфофункциональны-ми компонентами: стенками кровеносных сосудов, клетками крови (в первую очередь тромбоцитами) (рис. 123) и плазменными ферментными системами - свертывающей, фибринолитичес-кой (плазминовой), калликреин-кининовой и системой комплемента (рис. 124).
Первыми на повреждение реагируют кровеносные сосуды и клетки крови (тромбоциты и отчасти эритроциты). Именно этой реакции отводится ведущая роль в предупреждении и остановке кровотечений из наиболее легко травмируемых микрососудов. В связи с этим сосудис-то-тромбоцитарная реакция на повреждение обозначается как первичный гемостаз, а последующее свертывание крови - как вторичный, хотя оба эти механизма взаимно потенцируют друг друга и функционируют на большом отрезке времени сопряженно.
13.5.1. Сосудисто-тромбоцитарный гемостаз
На повреждение микрососуды отвечают спаз-
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
| ПОВРЕЖДЕНИЕ СОСУДА |
| т |
| Коллаген |
| АДФ <— I Лабилизация мембраны тромбоцитов |
| Гемолиз Высвобождение Са2* |
| Фактор Виллебранда*" _ Реакция * высвобождения (АДФ,адреналин и др.) ч__ |
| т |
| АДГЕЗИЯ |
| Изменение формы, образование отростков, активация фосфоли-пазы А2 i Арахидоновая кислота |
| I |
| АГРЕГАЦИЯ I |
| Тромбоксан А2 |
| Ca2\Mg2\ if белковые' плазменные кофакторы ч |
| АГРЕГАЦИЯ |
Реакция высвобождения (4-й фактор, р-тромбоглобулин, ростовой фактор, тромбоспондин)
Тромбин
Фибриноген
Фибрин
СГУСТОК.ТРОМБ
РЕТРАКЦИЯ
Рис. 123. Схема сосудисто-тромбоцитарного гемостаза
мом, в результате чего капилляры и венулы временно запустевают и кровотечение из них в первые 20-30 с не возникает. Эта вазоконстрикция четко видна капилляроскопически при нанесении укола в ногтевое ложе и регистрируется по начальной задержке появления первой капли крови при проколе кожи скарификатором. Она обусловлена рефлекторным спазмом сосудов за счет сокращения их гладкомышечных клеток, что поддерживается вазоспастическими агентами, секретируемыми эндотелием и тромбоцитами, - серотонином, тромбоксаном А, норадрена-лином и др.
Функции эндотелия. В нормальных условиях эндотелий кровеносных сосудов обладает высокой тромборезистентностью, поддерживает жидкое состояние крови и препятствует образованию тромбов. Эти свойства эндотелия обеспечиваются следующими механизмами:
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
- отрицательным зарядом и контактной инертностью внутренней, обращенной в просвет сосуда поверхности этих клеток, в силу чего последняя не активирует системы гемостаза;
- синтезом мощного ингибитора агрегации тромбоцитов - простациклина (рис. 125);
- наличием на мембране эндотелиальных кле
ток особого гликопротеина - тромбомодулина,
связывающего и инактивирующего тромбин.
Благодаря этому тромбин утрачивает способность
вызывать свертывание крови, но сохраняет свое
активирующее действие на систему двух важ
нейших антикоагулянтов - протеинов С и S (см.
ниже). Иначе говоря, благодаря связыванию
тромбина с тромбомодулином на цитоплазмати-
ческой мембране эндотелия тромбин трансфор
мируется из главного фактора свертывания кро
ви в противосвертывающий агент;
- способностью стимулировать фибринолиз путем синтеза и выделения в кровь наиболее мощного активатора фибринолиза - тканевого плазминогенового активатора (ТПА), обеспечивающего лизис образующихся в сосудах тромбов;
- фиксацией на эндотелии кислых мукополи-сахаридов, в том числе гепарина и комплекса «гепарин - антитромбин III»;
- элиминацией из крови активированных факторов свертывания крови и их метаболитов.
Вместе с тем эндотелий обладает уникальной способностью менять свой антитромботический потенциал на тромбогенный, что происходит при его повреждении экзо- и эндотоксинами, антителами и иммунными комплексами (при иммунных васкулитах и инфекционно-иммунных процессах), медиаторами воспаления (цитокины, фактор некроза опухоли), лейкоцитарными про-теазами (эластазой и др.), при повреждающем действии Н202 и ряде метаболических поражений сосудов (диабет, гиперлипидемии, гиперго-моцистеинемия и др.).
Свойства субэндотелия. При гибели эндотелиальных клеток обнажается субэндотелий, содержащий в большом количестве коллаген. В контакте с последним происходят активация тромбоцитов, их приклеивание и распластывание на стенке сосуда (при участии особого плазменного гликопротеина - фактора Виллебранда, а также фибриногена и фибринонектина) и последующее образование в поврежденном сосуде тромбоцитарного (белого) тромба. С другой стороны, коллаген активирует свертывание крови
| альфа-2 Антиплазмин |
| Фибриноген, фибрин-мономер |
| ПДФ (D-димер) |
| Внутренний механизм Контактная активация (коллаген, каолин) |
 2015-03-22
2015-03-22 4027
4027
