ДВС-синдром - одна из наиболее частых и распространенных форм патологии гемостаза. Этот сложный патологический процесс характеризуется распространенным свертыванием крови и агрегацией клеток крови, вызывающей блокаду микроциркуляции в органах и тканях, множественное микротромбирование мелких сосудов, вследствие чего возникают ишемия и глубокая дисфункция жизненно важных органов. В связи с генерализованным свертыванием крови и агрегацией тромбоцитов развиваются коагулопа-
тия и тромбоцитопения потребления, обусловленные участием факторов свертывания и тромбоцитов в процессе образования множества тромбов, истощаются как механизмы гемокоагуля-ции (вплоть до полной несвертываемости крови), так и основные физиологические антикоагулянты (протеин С, антитромбин III), а также наиболее активная часть циркулирующих тромбоцитов. В микрососудах разрушаются эритроциты, в мазках крови обнаруживается множество их фрагментов. Все это ведет к развитию так называемого тромбо-геморрагического синдрома.
ДВС-синдром неспецифичен и универсален. Он возникает при всех тяжелых заболеваниях и терминальных состояниях - тяжелых травмах, ожогах, всех видах шока, сепсисе, внутрисосу-дистом гемолизе (в том числе при переливаниях несовместимой крови), при различных отравлениях и укусах ядовитых змей, при осложнениях в родах и травматичных хирургических вмешательствах, а также при многих других видах патологии человека. Если острый ДВС-синдром характерен для всех крайне тяжелых и терминальных состояний, то затяжные (хронические) его формы наблюдаются при злокачественных новообразованиях, лейкозах, хронических воспалительных процессах.
Для ДВС-синдрома характерна полиорганная симптоматика. Важнейшими из них являются поражение и дисфункция органов-мишеней: 1) развитие острой легочной недостаточности (вплоть до легочного дистресс-синдрома); 2) острая почечная, или гепаторенальная, недостаточность со снижением диуреза и уремией; 3) церебральная симптоматика, связанная с ишемией мозга; 4) поражение слизистой оболочки желудка и кишечника, сопровождающееся обильными кровотечениями, развитием острых гипок-сических язв, вторичным инфицированием организма кишечной микрофлорой; 5) надпочечни-ковая, или плюригландулярная, эндокринная недостаточность с нестабильной гемодинамикой; 6) синдром системной воспалительной реакции с накоплением в крови цитокинов и других метаболитов.
Острый и подострый ДВС-синдромы проходят в своей эволюции три фазы: I - стадию гиперкоагуляции, которая тем короче (вплоть до нескольких минут), чем острее протекает процесс; II - переходную стадию, при которой показания коагуляционных тестов разнонаправлены:
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
одни из них продолжают выявлять гиперкоагуляцию, тогда как другие обнаруживают гипоко-агуляцию; III - стадию резко выраженной ги-покоагуляции вплоть до несвертываемости крови. Однако ряд фундаментальных нарушений прогрессирует неуклонно однонаправленно, и это наиболее важно. Так, неуклонно снижается содержание в плазме крови важнейших физиологических антикоагулянтов и тромбоцитов, а также некоторых факторов свертывания, остаются на высоком уровне и нарастают продукты расщепления фибриногена (пептид А, фибрин-мономеры), РФМК, продукты фибринолиза и D-димер. При успешной компенсации этих нарушений и прекращении внутрисосудистого свертывания крови все эти сдвиги подвергаются обратному развитию. Лечение должно быть также направлено на восстановление микроциркуляции в органах и нормализацию их функции.
13.5.7.Тромбофилические состояния
Термином «тромбофилии» обозначаются все наследственные (генетически обусловленные) и приобретенные нарушения гемостаза, которым свойственна предрасположенность к раннему появлению и рецидивированию тромбозов и облитераций кровеносных сосудов.
Согласно принятой в настоящее время классификации [Баркаган З.С., 1996] тромбофилии подразделяют на ряд основных групп (табл. 64).
В первую группу гематогенных тромбофилии включаются все гемореологические формы, при которых наклонность к тромбозам связана со сгущением крови, повышением ее вязкости, ге-матокритного показателя, содержания гемоглобина и эритроцитов, а также с изменениями формы и деформируемости эритроцитов (при талассемии и других гемоглобинопатиях). Наиболее характерны такие тромбофилические состояния для истинной полицитемии и сгущений крови, связанных с обильной потерей организмом воды (интенсивное потоотделение, профуз-ные поносы и т.п.).
Во вторую группу включаются тромбофилии, обусловленные значительным (до 1200 • 109/л.) повышением количества тромбоцитов в крови (эссенциальная тромбоцитемия), а также тромбозы, связанные с повышенной адгезивностью и агрегацией тромбоцитов (синдром вязких тромбоцитов первичный и при атеросклерозе, диабете, приеме противозачаточных гормональных
препаратов и др.). В эту же группу входят тромбофилии, связанные с гиперпродукцией и повышением мультимерности фактора Виллебранда.
В третью группу тромбофилии включают все формы, обусловленные наследственным или приобретенным дефицитом или аномалиями важнейших физиологических антикоагулянтов - антитромбина III, протеина С, протеина S и TFPI.
К четвертой группе тромбофилии относят формы, обусловленные наследственными аномалиями плазменных факторов свертывания крови, в силу чего эти факторы утрачивают чувствительность к физиологическим антикоагулянтам или к фибринолизу. Наиболее частая из этих форм - аномалия фактора V Лейден, при которой фактор Va утрачивает способность инакти-вироваться протеином С. Эта форма обозначается как резистентность фактора Va к активированному протеину С. Она очень часта у европейцев и нередко встречается в российской популяции. Другими достаточно частыми тром-бофилиями этой группы являются аномалии фактора II и ряд аномалий фибриногена (дис-фибриногенемии). Намного реже тромбозы бывают связаны с дефицитом или аномалиями фактора XII (фактор Хагемана), при которых, как и при дисфибриногенемиях, наблюдается сочетание гипокоагуляции с нарушениями фибринолиза, формирующими тромбофилическое состояние.
Пятая группа тромбофилии представлена генетически обусловленными или приобретенными нарушениями фибринолиза, в основе которых чаще всего лежат недостаточная продукция в эндотелии тканевого плазминогенового активатора или аномалии плазминогена.
К шестой группе относят инфекционно-им-мунные и аутоиммунные тромбофилии, среди которых доминирует антифосфолипидный синдром, при нем нарушается взаимодействие на фосфолипидных мембранах факторов свертывания крови между собой и с физиологическими антикоагулянтами, а также снижается тромбо-резистентность эндотелия. В эту же группу включают множественные тромбозы и инфаркты органов при затяжном бактериальном эндокардите, миокардиопатиях, ряде вирусно-иммунных заболеваний (в том числе при тромботической тромбоцитопенической пурпуре).
К седьмой группе относят тромбофилии метаболического генеза, связанные со снижением
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Важнейшие гематогенные тромбофилии
Таблица 64
| Формы тромбофилии | Патогенез |
| I. Гемореологическая группа II. Формы тромбоцитарного генеза III. Формы, связанные с дефицитом физиологических антикоагулянтов IV. Формы, связанные с аномалиями факторов свертывания V. Нарушения фибринолиза VI. Иммунные и инфекционно-иммунные формы болезнь Бехчета VII. Комплексные нарушения гемостаза метаболического генеза | Полиглобулии, повышение вязкости крови Гипертромбоцитозы и тромбоцитемии, гиперагрегационные формы (синдром вязких тромбоцитов), высокий уровень и мультимерность ФВ Дефицит антитромбина III, протеина С, протеина S, кофактора гепарина II, TFPI, тромбомодулина Фактор V Лейден - АРС резистентность, симптоматические формы АРС резистентности, мутация протромбина G 20210 А, первичная и вторичная гиперактивации фактора VII, дисфибриногенемии Дефицит ТПА, аномалии плазминогена, избыток PAI-1 Антифосфолипидный тромботический синдром, тромбэндокардиты, тромбоваскулиты, миокардиопатии, затяжной септический эндокардит, Гиперлипидемии, гипергомоцистеинемии, диабет I и II типа и др. |
антитромботического потенциала эндотелия и комплексными нарушениями во всех звеньях системы гемостаза. В эту группу входят тромбофилии при гиперлипидемиях, гипергомоцисте-инемиии, диабетической ангиопатии и ряде других эндокринных нарушений.
В особую группу включают медикаментозные и другие ятрогенные тромбофилии, патогенез которых весьма неоднороден. В частности, сюда входят частые тромбозы при лечении L-acnapa-гиназой и приеме эстрогенных противозачаточных препаратов, гепариновая тромбоцитопения с рикошетными тромбозами, тромбозы сосудов печени при трансплантациях костного мозга и ряд других форм.
Заканчивая рассмотрение тромбофилии, следует особо подчеркнуть, что нельзя ставить знак равенства между понятиями « гиперкоагуляци-онное» и «тромбофилическое» состояние, поскольку многие виды тромбофилии (при дефиците фактора XII, дисфибриногенемиях, анти-фосфолипидном синдроме и др.) протекают со снижением, а не с повышением свертываемости крови и при еще большем числе форм этой патологии параметры обычной коагулограммы остаются в нормальных пределах. В силу этого распознавание различных тромбофилии требует применения специальных методов исследования, выявляющих типичные для каждой из этих форм нарушения гемостаза.
В целом четкое разграничение и диагностика
различных тромбофилии имеют исключительно большое значение, поскольку позволяют проводить их дифференцированную профилактику и терапию, а при ряде форм этой патологии осуществлять полное излечение больных.
13.6. ИЗМЕНЕНИЕ НЕКОТОРЫХ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ КРОВИ
13.6.1. Изменение скорости оседания эритроцитов
Скорость оседания эритроцитов (СОЭ) в норме составляет: у женщин - от 2 до 15, у мужчин - от 1 до 10 мм/ч, у новорожденных - 2 мм/ч. При многих заболеваниях величина СОЭ может изменяться, что зависит от следующих факторов:
1. От изменения соотношения различных фракций белков крови. Увеличение содержания крупнодисперсных белков (глобулины, фибриноген) при воспалительных процессах и некоторых инфекционных заболеваниях ведет к изменению СОЭ - слабо заряженные крупнодисперсные белки, адсорбируясь на отрицательно заряженных эритроцитах, уменьшают их поверхностный заряд и способствуют тем самым сближению и более быстрому оседанию последних (табл. 65).
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
2. От объема, числа и диаметра эритроцитов. Увеличение замедляет, а уменьшение ускоряет оседание эритроцитов.
3. От содержания холестерина и лецитина в крови. Холестерин, адсорбируясь на эритроцитах, ускоряет, а лецитин, напротив, замедляет СОЭ.
4. От изменения относительной плотности эритроцитов. При гиперкапнии (асфиксия, сердечная декомпенсация) СОЭ замедляется вследствие увеличения диаметра эритроцитов и уменьшения их относительной плотности.
5. От вязкости крови. Гидремия приводит к ускорению оседания эритроцитов, с увеличением вязкости крови (обезвоживание) СОЭ замедляется.
Большое влияние на СОЭ оказывают прием некоторых лекарств и терапевтические мероприятия. Так, ускорение оседания эритроцитов отмечается при специфической и неспецифической раздражающей терапии, вакцинотерапии, переливании крови, длительных приемах соды и т. д. Замедление СОЭ наблюдается при приеме салициловых, ртутных и кальциевых препаратов, диуретиков, снотворных и противомалярийных средств.
В физиологических условиях СОЭ увеличивается при беременности (во второй половине) и при интенсивной физической работе.
13.6.2. Изменение резистентности эритроцитов
Резистентность эритроцитов - способность их противостоять различным разрушительным воздействиям: осмотическим, механическим, химическим, физическим и пр. Наибольшее практи-
ческое значение имеет определение осмотической резистентности - устойчивости эритроцитов в гипотонических растворах.
В гипертонических солевых растворах эритроциты теряют воду и сморщиваются, а в гипотонических - поглощают воду и набухают. При значительном набухании происходит гемолиз. Изотоническим раствором для эритроцитов является 0,85%-ный раствор хлорида натрия. В 0,48-0,44%-ных растворах NaCl разрушаются наименее резистентные эритроциты (минимальная осмотическая резистентность, верхняя граница резистентности). При концентрации 0,32-0,28% полностью гемолизируются все эритроциты (максимальная осмотическая резистентность, нижняя граница резистентности).
Уменьшение осмотической резистентности эритроцитов (повышение показателей минимальной и максимальной резистентности) наблюдается при гемолитической болезни новорожденных и наследственном микросфероцитозе, а также (в слабой степени выраженности) при токсикозах, бронхопневмониях, гемобластозах, циррозах печени и др. Увеличение осмотической резистентности эритроцитов имеет место при механической желтухе, в некоторых случаях полицитемии и железодефицитной анемии, а также при гемоглобинозе S и после массивных кровопотерь.
13.6.3. Нарушение белкового состава плазмы крови
В плазме крови человека присутствуют более 200 белков, большая часть из них выделена и описана структурно и функционально. Концентрации отдельных белков в плазме различны.
Влияние белков плазмы на скорость оседания эритроцитов
Таблица 65
Заболевание
СОЭ
Причина
Острое воспаление
Цирроз печени
Лейкозы
Моноклональные гаммапатии
Анемии
Первичные и вторичные полиэритремии
Криоглобулинемия
Т t t t
t
4 4
Фибриноген Т, альбумин 4 Иммуноглобулины t, альбумин 44 Альбумин 44, эритроциты 4 Фибриноген Т, альбумин 4, эритроциты Иммуноглобулины tt Эритроциты 4 Эритроциты t Моноклональные иммуноглобулины Т
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Количественно наиболее представлен альбумин. Изменения концентрации индивидуальных белков имеют место при многих как физиологических, так и патологических состояниях, тем не менее биологическое значение этих изменений хорошо изучено лишь для незначительного числа белков.
Большинство белков плазмы представлено гликопротеинами обычно с содержанием углеводов от 10 до 25%, исключение составляет альбумин, который не гликозилирован. Изоэлект-рическая точка большинства белков плазмы находится в диапазоне кислых значений рН, т. е. они движутся к аноду при электрофорезе в щелочном буфере.
С клинической точки зрения удобно разделять белки по их функции (табл. 66), поэтому специфический индивидуальный белок может быть отнесен более чем к одной группе.
Физиологическая функция белков плазмы состоит в поддержании коллоидно-осмотического давления, буферной емкости плазмы, в осуществлении транспорта и депонировании молекул липидов, продуктов метаболизма, гормонов, лекарственных веществ и микроэлементов. Белки плазмы выполняют ферментативную функцию, иммуноглобулины осуществляют гуморальный иммунитет. Компоненты комплемента и СРБ важны для неспецифического иммунитета, особенно в случае бактериальной инфекции. Равновесие между факторами и ингибиторами свертывания обеспечивает жидкое состояние крови в норме и быстрое свертывание при повреждении. При непосредственном участии белков плазмы протекают все физиологические и патофизиологические реакции в организме.
Концентрация белка в плазме зависит от скорости синтеза, скорости удаления и объема рас-
пределения. Альбумины, а-глобулины и часть Р-глобулинов синтезируются в печени, у-глобулины и часть р-глобулинов - в клетках лимфо-идной ткани. Концентрация белка в плазме может быстро меняться - через 30 мин в положении стоя после длительного лежания она может увеличиться на 10-20%, после венопункции может измениться в течение нескольких минут. В обоих случаях это связано с перераспределением жидкости между внутрисосудистым пространством и интерстицием. Факторы, влияющие на концентрацию белков в плазме, представлены в табл. 67.
Только существенные изменения уровня альбумина и иммуноглобулинов оказывают значительный эффект на концентрацию общего белка в сыворотке. За исключением массивных кровотечений или внутривенного введения белков, быстрое увеличение содержания общего белка всегда связано со снижением объема распределения, быстрое снижение - с увеличением объема плазмы. Для анализа этой ситуации следует учитывать показатель гематокрита. Концентрация общего белка в плазме также быстро снижается при увеличении проницаемости капилляров, так как белок способен быстро диффундировать в интерстициальное пространство. Это может наблюдаться у больных с сепсисом или генерализованным воспалением. Причины увеличения и снижения концентрации общего белка в сыворотке представлены в табл. 67.
Гипопротеинемия - уменьшение концентрации белков в крови. Существуют различия между абсолютной гипопротеинемией, например после увеличения выделением почками альбумина
Белки плазмы крови
Таблица 66
| Функциональные группы белков | Пример |
| Транспортные белки Белки острой фазы Комплемент Факторы свертывания Ферменты Ингибиторы протеиназ Белковые гормоны Иммуноглобулины Белки, поддерживающие онкотическое давление Белки, поддерживающие буферную емкость плазмы | Трансферрин, тироксинсвязывающий белок С-реактивный белок, фибриноген СЗ.С4 Протромбин, фактор VIII, фибриноген Амилаза, ренин,холинэстераза а,-антитрипсин, антитромбин III Инсулин, глюкагон, вазопрессин G,M,A Все белки, особенно альбумин Все белки |
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
Факторы, влияющие на концентрацию белков плазмы крови
Таблица 67
| физиологические факторы | |
| Возраст | Недоношенные 36-60 г/л Новорожденные 46-70 г/л Дети 50-75 г/л Взрослые 64-83 г/л |
| Пол | Мужские и женские половые гормоны влияют на концентрацию многих белков: а-фетопротеин, ферритин, IgM |
| Лекарства | Влияние оказывают оральные контрацептивы, тестостерон, фенотиазины, эстрогены |
| Физическая нагрузка | Активная физическая работа повышает белок до 10% |
| Генетические факторы | Имеют значение фенотипы, связанные с расовыми различиями, наследственный дефицит отдельных белков |
| Питание | Влияет на комплемент, преальбумин, ретинолсвязывающий белок |
| Беременность | Влияет на транспортные белки, существенно меняет а-фетопротеин |
| Сон | Продолжительный сон может менять концентрацию белков |
| Окружающая среда | У жителей тропиков уровень иммуноглобулинов выше, чем в зоне с холодным климатом |
| Патологические факторы | |
| Потери | Патологические потери через поврежденный орган, например при нефротическом синдроме, клубочковой и канальцевой протеинурии, потери через кишечник |
| Синтез | Синтез белков плазмы нарушается при заболеваниях печени и почек, возможна фенотипическая недостаточность |
| Изменение объема циркулирующей крови | Происходит в результате гипер-, гипогидратации или перераспределения между водными пространствами организма |
| Катаболизм | Усиливается при воспалении |
| Скорость утилизации | Меняется при воспалении, заболеваниях почек |
| Компенсаторные механизмы | Возрастает количество высокомолекулярных белков принефротическом синдроме |
при их патологии или в результате нарушения синтеза при хроническом циррозе печени, и относительной гипопротеинемией, например в результате избыточной инфузионной терапии или значительно уменьшенном количестве мочи (оли-гурия, анурия).
Как правило, основной причиной гипопроте-инемии является гипоальбуминемия. Недостаточный синтез альбумина в печени может быть связан с уменьшенным поступлением аминокислот или с повреждением гепатоцитов. Нарушение всасывания в кишечнике (синдром мальаб-сорбции) может быть результатом бактериальной или паразитарной (лямблиоз) инфекции, муковисцидоза, колита, дисахаридазной недостаточности, энтеропатии с потерей белков или демпинг-синдрома. Поражение гепатоцитов может
иметь место при циррозе, токсикозе, атрофии, метастазировании или первичном раке печени. Потеря белка возникает при:
- нефротическом синдроме при гломерулонеф-рите (80%), диабете, системной красной волчанке и других аутоиммунных заболеваниях, ами-лоидозе, тромбозе почечных вен;
- энтеропатии в результате заболеваний желудка или кишечника, колита, полипов, цирку-ляторной недостаточности;
- поражениях кожи: ожоги, дерматоз;
- экссудатах и транссудатах: перитонит, плеврит, асцит;
- коагулопатии;
- усиленном катаболизме: сепсис, лихорадки, множественные поражения, злокачественные опухоли.
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Клинико-диагностическое значение изменения концентрации общего белка крови
Таблица 68
| Повышение концентрации | Снижение концентрации |
| Дегидратация: недостаточное питье; избыточные потери воды при потоотделении, профузных поносах, болезни Аддисона, диабетическом кетоацидозе Увеличение содержания одного или нескольких специфических белков: острые и хронические инфекции; аутоиммунные болезни; парапротеинемические гемобластомы, (миеломная болезнь, болезнь Вальденстрема, болезнь тяжелых цепей); лимфогранулематоз; саркоидоз; активный хронический гепатит; цирроз печени без выраженной печеночноклеточной недостаточности | Пониженный синтез белка: недостаток белка в пище, голодание; мальабсорбция, энтериты, панкреатиты; болезни печени (цирроз, атрофия и др.); длительное лечение кортикостероидами Увеличенные потери белка: гломерулонефрит и другая патология почек; сахарный диабет; асцит, экссудаты и транссудаты; ожоги; кровотечения Повышенный распад белка: тиреотоксикоз; длительная физическая нагрузка; длительная лихорадка; травмы; опухоли Гипергидратация |
Гиперпротеинемия - повышение концентрации общего белка в крови. Выделяют две основные причины повышения концентрации общего белка в сыворотке крови: уменьшение объема плазмы при дегидратации и повышение содержания в плазме одного или нескольких специфических белков. В связи с этим проводятся различия между абсолютной гиперпротеинеми-ей, например повышение концентрации иммуноглобулинов (парапротеинемия), и относительной гиперпротеинемией при дегидратации. Гиперпротеинемия не может быть результатом усиленного синтеза альбумина, поэтому гипераль-буминемия указывает на дегидратацию или артефакты (стаз крови при венопункции).
Выраженное поликлональное увеличение концентрации иммуноглобулинов наблюдается при хроническом бактериальном воспалении, обострении вирусных инфекций (в частности, ВИЧ), хронических заболеваниях печени (хронический и подострый гепатит), аутоиммунных болезнях (ревматоидный артрит, дерматомиозит), саркои-дозе. Заподозрить гиперпротеинемию можно при изменении скорости оседания эритроцитов (СОЭ) (табл. 68).
Диспротеинемия означает, что имеются количественные и качественные изменения концентрации нормальных белков плазмы, например при остром воспалении, циррозе печени, болезнях почек, парапротеинемии, опухолях.
Диспротеинемия может быть обусловлена увеличением или уменьшением концентрации отдельных групп белков или продукцией новых белков, которые до этого не выявлялись. Диспротеинемия определяется путем электрофореза.
Гипоальбуминемия. Возможные причины гипоальбуминемии представлены в табл. 69.
Известно более 20 генетических вариантов альбумина, что никак не связано со склонностью к заболеваниям. Этот эффект обозначается как бисальбуминемия. Наследственное отсутствие альбумина - анальбуминемия - асимпто-матична, может проявляться лишь определенной склонностью к отекам.
В клинической практике гипоальбуминемия чаще всего является следствием потери альбумина при нефротическом синдроме, гастроэнтерите, активации катаболизма. При ожоговой болезни гипоальбуминемия развивается вследствие потери жидкости, изменения сосудистой проницаемости, угнетения синтеза. Выраженная гипоальбуминемия наблюдается при портальном циррозе и жировой дистрофии печени, амилои-дозе, кахексии, тяжелых инфекциях, панкреатите, коллагенозах.
Гиперальбуминемия может быть либо артефактом (в частности, при взятии венозной крови в момент стаза), либо результатом чрезмерного внутривенного введения альбумина при
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
Таблица 69 Клинико-диагностическое значение изменения содержания альбумина плазмы крови
| Функция | Концентрация | ||
| Норма | Повышенная | Сниженная | |
| Связывание и транспорт катионов (Cu2*,Zn2t,Ca24), малых и больших анионов, билирубина, жирных кислот, витамина С, лекарств, гормонов щитовидной железы Нормализация онкотического (коллоидно-осмотического) давления Резерв белка (аминокислот) | 37-53 г/л | Острое обезвоживание Прием анаболических стероидов | Пониженный синтез,цирроз печени, недоедание, синдром мальабсорбции, анальбуминемия Повышенный катаболизм:травма, инфекция, сепсис, лихорадка, опухоли, гипоксия, синдром Кушинга, гипертиреоз, гиперкортицизм Аномальные потери:шок, кровотечение, энтероколиты, нефротический синдром Патологическое распределение:после операционного вмешательства, при ожогах, токсикозе, асците, плеврите |
Для прогноза: неблагоприятна пониженная концентрация, в то время как повышение ее указывает на выздоровление.
инфузиях, либо связана с дегидратацией. При некоторых патологических состояниях отмечается повышенный синтез альбумина, однако это, как правило, не приводит к гиперальбуминемии.
Белки острой фазы
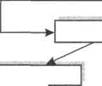
В ответ на повреждение при физической травме, ожогах, хирургических операциях, инфекциях и т.д. в организме развивается комплекс физиологических реакций, направленных на локализацию очага повреждения и скорейшее восстановление нарушенных функций (см. также гл. 3 и 9). Комплекс местных и системных изменений, возникающих непосредственно вслед за повреждением, в совокупности составляет понятие острой фазы воспаления (схема 28).
Важнейший аспект острой фазы - радикальное изменение биосинтеза белков в печени. Понятие «белки острой фазы» объединяет до 30 белков плазмы крови, так или иначе участвующих в воспалительном ответе на повреждение. Концентрация белков острой фазы существенно зависит от стадии, течения заболевания и массивности повреждения, что определяет ценность этих тестов для диагностики.
Регуляция и контроль синтеза белков острой фазы. Развитие острой фазы воспалительного ответа инициируется и регулируется рядом медиаторов: цитокинами, анафилоксинами, факторами роста и глюкокортикоидами. Некоторые из них выделяются непосредственно в очаге воспаления активированными макрофагами, лим-
фоцитами, фибробластами и другими клетками и могут оказывать как местное, так и общее воздействие.
Цитокины обеспечивают своего рода коммуникационную сеть. Регуляция синтеза белков острой фазы - сложный многофакторный механизм, отдельный для каждого белка. Каждый из цитокинов выполняет уникальную независимую функцию. В общих чертах можно представить, что цитокины действуют как первичные стимуляторы генной экспрессии, глюкокортико-иды и факторы роста являются модуляторами действия цитокинов.
Как правило, концентрация белков острой фазы меняется в течение первых 24-48 ч. Классически острая фаза длится несколько дней (см. схему 28), что указывает на защитную, гомеос-татическую природу этого важного ответа. Однако цикл может быть пролонгирован при продолжении действия повреждающих факторов или при нарушении механизмов контроля и регуляции. При нарушении механизмов регуляции острой фазы повреждение тканей может продолжаться и привести к развитию последующих осложнений, например сердечно-сосудистых заболеваний, болезней накопления, аутоиммунных заболеваний и коллагенозов.
Характеристика и классификация белков острой фазы. Особенностью большинства белков острой фазы является их неспецифичность и высокая корреляция концентраций в крови с
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Реакции острой фазы воспаления
Схема 28
Повреждающие факторы: хирургическое вмешательство ожог травма
бактериальная инфекция рост и развитие опухоли химические агенты другие
 | |||||||||||
 |  | ||||||||||
 | |||||||||||
 | |||||||||||
 |
| Общая реакция: • боль • ^ температуры • лекоцитоз • ^Fez* и Zn2t в сыворотке • -^секреции гормонов • 4синтеза белков острой фе |
| S |
| _--------::: V -----------.......... ' ' Репаративные процессы |
Местная реакция:
 |
| Острая фаза воспаления |
| Повреждение и некроз клеток |
• изменение просвета кровеносных сосудов
• агрегация тромбоцитов и тромбообразование
• активация нейтрофилов и макрофагов
• освобождение протеаз и других лизосомальных ферментов
• образование кининов.простагландинов и других медиаторов
активностью заболевания, стадией процесса. Это выгодно отличает белки острой фазы от таких показателей, как СОЭ, подсчет количества лейкоцитов и сдвиг лейкоцитарной формулы. В связи с этим наиболее эффективно использовать тесты на белки острой фазы для мониторинга течения заболеваний, контроля лечения. В то же время диагностическая значимость этих тестов в силу их неспецифичности может быть весьма ограниченной. Концентрация разных белков в условиях повреждения и воспаления варьирует в широких пределах (рис. 129).
К «главным» белкам острой фазы у человека относят С-реактивный белок (СРВ) и амилоидный А белок сыворотки крови. Уровень этих белков возрастает при повреждении очень быстро (в первые 6-8 ч) и значительно (в 20-100 раз, в отдельных случаях в 1000 раз).
Вторую группу составляют белки, концентрация которых может увеличиваться существенно (в 2-5 раз). Тесты на о^-антитрипсин, сц-кис-лый гликопротеин (орозомукоид), гаптоглобин, фибриноген имеют очевидную информативность при многих заболеваниях.
Индивидуальной оценки требует интерпретация результатов измерения концентрации церу-лоплазмина, СЗ- и С4-компонента комплемента, уровень которых увеличивается на 20-60% от исходного и в ряде случаев не превышает диа-
пазона вариации нормальных концентрации этих белков в плазме крови здорового человека.
К так называемым нейтральным реактантам острой фазы относятся белки, концентрация которых может оставаться в пределах нормальных значений, однако они принимают участие в реакциях острой фазы воспаления. Это а2-макро-глобулин, гемопексин, амилоидный Р белок сыворотки крови, иммуноглобулины.
Содержание «негативных» реактантов острой фазы может снижаться на 30-60%. Наиболее диагностически значимыми из этой группы белков являются альбумин, трансферрин, anoAl-липопротеин, преальбумин. Уменьшение концентрации отдельных белков в острой фазе воспаления может быть обусловлено снижением синтеза, увеличением потребления, изменением их распределения в организме.
При острых воспалительных заболеваниях, сепсисе самым чувствительным и самым быстрым маркером повреждения является С-реактивный белок. Для определения и наблюдения за течением хронических процессов желательно следить за изменением концентрации сразу нескольких более медленно реагирующих белков -ctj-кислого гликопротеина, сц-антитрипсина. Использование только одного из маркеров воспаления рискованно, так как у разных больных возможен дисгармоничный острофазный ответ.
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
 Оценка стадии реакции острой фазы
Оценка стадии реакции острой фазы
Таблица 70
| Стадия | а,- кислый гликопротеин | о^-антитрипсин | СРБ |
| Реакция острой фазы | Т | t | t |
| Повышенный уровень кортикостероидов | t | = | = |
| Повышенный уровень эстрогенов | = | t | = |
| Начало реакции острой фазы | = | = | t |
| Стихание реакции острой фазы | t | t | =(T) |
В частности, в начальной стадии острого воспаления характерно снижение содержания белков, обладающих антипротеазной активностью (cXj-антитрипсин, с^-антихимотрипсин, а2-макро-глобулин), что связано с высоким их потреблением. В последующем отмечается повышение их концентраций, связанное с увеличением синтеза этих белков. Снижение уровней ингибиторов протеиназ при септическом шоке или остром панкреатите является плохим прогностическим признаком. Повышенное потребление гаптоглобина, СЗ-компонента комплемента, фибриногена может указывать на наличие сопутствующего патологического процесса, помимо воспаления.
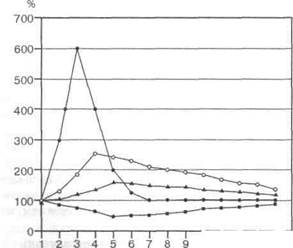
1 1 1 I Г 10 11 12 13 14
4 Дни
Рис. 129. Динамика изменения концентрации белков острой фазы в плазме крови после травмы, ожога, хирургического вмешательства (в процентах от исходного уровня): 1 - С-реактивный белок, амилоидный А белок сыворотки; 2 - сц-антитрип-син, о^-кислый гликопротеин, гаптоглобин, фибриноген; 3 - СЗ- и С4-комплементы, С1-ингибитор, церулоплазмин; 4 - альбумин, преальбумин, транс -феррин, фибронектин, апоА-липопротеин
Одновременное определение нескольких белков позволяет оценить стадию острой фазы, а также реакцию, связанную с эффектами гормонов, в частности кортикостероидов и эстрогенов (табл. 70).
Иммуноглобулины (см. также гл. 6)
Иммуноглобулины - группа у-глобулинов с идентичной базовой структурой, но отличающаяся по иммунологическим, биологическим и физическим свойствам. Синтезируются и секре-тируются они лимфоцитами В-линии. В-лимфо-циты формируются в костном мозге, дозревают в лимфатических узлах и периферической крови, где у них на поверхности развиваются многочисленные рецепторы к иммуноглобулинам. При антигенной стимуляции В-лимфоциты продуцируют в основном IgM. При пролиферации В-лимфоциты превращаются в плазматические клетки, которые секретируют в кровь высокоспецифичные антитела класса IgG, способные связывать дополнительное количество антигенов.
IgG - основной класс антител сыворотки. Антитела класса IgG продуцируются в ответ на проникновение в организм большинства бактерий и вирусов, способны агрегировать и покрывать небольшие растворимые белки, такие как бактериальные токсины. Они участвуют в формировании активного иммунитета и иммунологической памяти. К IgG относятся изоиммунные антирезус и групповые иммунные антитела неполного характера, изоиммунные противолейко-цитарные антитела лейкоагглютинирующего характера, аутоиммунные тепловые противоэрит-роцитарные антитела. Антитела класса IgG активируют систему комплемента, связываются с антигенами на клеточной поверхности, представляя эти клетки для фагоцитоза (опсонизация). IgG, как самые мелкие иммуноглобулины, могут проникать через плацентарный барьер из
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
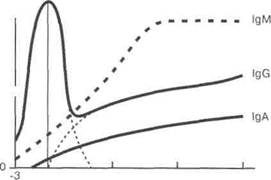
 крови матери в кровь плода. Так как до рождения существенной продукции антител не происходит (рис. 130) - для этого нужен контакт с чужеродным агентом - IgG матери служат важным механизмом защиты новорожденного от инфекции.
крови матери в кровь плода. Так как до рождения существенной продукции антител не происходит (рис. 130) - для этого нужен контакт с чужеродным агентом - IgG матери служат важным механизмом защиты новорожденного от инфекции.
IgA составляют 10-15% иммуноглобулинов
сыворотки, они могут представлять собой как
мономеры, так и полимеры. Вторая и, вероятно,
наиболее форма IgA - это секреторные
IgA. Они содержатся в различного рода продуктах внешней секреции (слезная жидкость, слюна, пот, слизь бронхиального и кишечного эпителия). Секреторные IgA - это первая линия защиты против бактериальных и вирусных антигенов. Они отвечают за местную защитную реакцию против антигенов, контактирующих со слизистыми оболочками. В частности, в желудочно-кишечном тракте лимфоциты и макрофаги ассоциированы с эпителиальными клетками, они и лимфатические узлы мезентерия обеспечивают локальный иммунный ответ на пищевые антигены и бактерии кишечника. Секреторные IgA, продуцируемые В-клетками, внутри слизистого слоя селективно связываются с бактериями и предупреждают их адгезию к стенке. Тем самым обеспечивается защита организма от проникновения внутрь бактерий из кишечника. Присутствие IgA в грудном молоке защищает новорожденных от кишечной инфекции.
IgM - самые крупные антитела. Этот класс представлен антителами, синтез которых начинается до рождения ребенка. IgM первыми появляются в сыворотке после введения антигена. Антитела обладают высокой комплементарной активностью. В-лимфоциты имеют поверхностные рецепторы и секретируют IgM первыми -«первичный ответ» на антиген. После трансформации В-лимфоцита в плазматическую клетку следующие стимуляции тем же самым антигеном вызывают выраженный «вторичный ответ», теперь уже с секрецией IgG плазматическими клетками.
IgM способны нейтрализовать инородные частицы и, благодаря наличию множественных участков связывания, вызывать агглютинацию клеток. К IgM принадлежат антимикробные антитела, антитела системы групп крови АВО, хо-лодовые аутоиммунные противоэритроцитарные антитела, ревматоидные факторы и, по-видимому, изо- и аутолимфоцитотоксины. IgM способ-
ны эффективно активировать систему комплемента. Из-за больших размеров IgM не могут попасть в межклеточное пространство и фильтроваться в клубочках почек.
IgE - мономерные иммуноглобулины, к ним относятся главным образом антитела-реагины. Они функционируют как связанные с клетками рецепторы антигенов. IgE соединяются со специальными рецепторами на поверхности базо-фильных гранулоцитов и тучных клеток. Когда IgE встречается с соответствующим антигеном, клетка-носитель этого иммуноглобулина секре-тирует гистамин и другие вазоактивные вещества, вызывающие аллергическую реакцию. IgE участвуют в процессах, вызывающих бронхиальную астму, экзему и другие аллергические заболевания.
Гипогаммаглобулинемия
Гипогаммаглобулинемия у новорожденных,
Физиологическая гипогаммаглобулинемия имеет место у новорожденных (см. рис. 130). Контакт новорожденных с антигенами стимулирует В-лимфоциты, которые начинают активно продуцировать IgM. После трансформации в плазматические клетки начинается синтез и секреция IgG и IgA. Этот процесс происходит с одновременным снижением содержания материнских IgG, поэтому у детей уровень IgG минимален в возрасте 3 мес. В связи с этим особенно сильно подвержены инфекциям две группы детей: недоношенные, так как у них меньше, чем у доно-
% 1д от уровня у взрослых
| 100- |
| 50- |
 Рождение
Рождение
0 if 6 12 18
igG |gG Возраст, мес
ребенка матери
Рис. 130. Изменение концентрации иммуноглобулинов в сыворотке у новорожденных
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
шенных, материнских IgG, и дети, у которых происходит временная задержка синтеза IgG. В этом случае требуется вмешательство, направленное на активацию синтеза IgG.
Патологическая гипогаммаглобулинемия. Патологическая гипогаммаглобулинемия как у детей, так и у взрослых может быть и врожденной, и приобретенной. В обоих случаях это сопровождается иммунодефицитом. Иммунная реакция определяется четырьмя основными комплексными системами: 1) гуморальными антителами (иммуноглобулинами), секретируемыми В-лимфоцитами; 2) клеточным иммунитетом, обеспечиваемым Т-лимфоцитами; 3) фагоцитами-макрофагами; 4) комплементом. По крайней мере две из этих систем неспецифичны и не имеют иммунологической памяти на антиген. Первая и четвертая системы представлены плазменными белками.
Врожденные дефекты иммунной системы достаточно редки. Они могут затрагивать В- и/или Т-клетки, фагоциты или систему комплемента. Из них примерно 50-75% приходится на нарушения образования иммуноглобулинов, 5-10% на клеточные иммунодефициты, 10-25% на комбинированные иммунодефициты и около 1-2% на нарушения фагоцитоза и системы комплемента. Неверно ставить диагноз иммунодефицита только на основании определения уменьшения в сыворотке содержания IgG, IgA, IgM, следует провести сопоставление лабораторных и клинических данных, включая анализ частых, особенно инфекционных заболеваний. В то же время ранняя постановка диагноза необходима для лечения больных с иммунодефицитами, это наиболее важно для детей.
Приобретенных иммунодефицитов значительно больше, чем врожденных. При злокачественных лимфомах и опухолях, болезни Ходж-кина, хроническом лимфолейкозе, плазмоцито-ме нарушается гуморальный и клеточный иммунитет. Концентрация иммуноглобулинов в сыворотке может быть снижена в разной степени, а иногда и увеличена. Лечение цитостатика-ми, стероидными гормонами, глюкокортикоида-ми, рентгеновское облучение, ионизирующая радиация влияют на образование иммуноглобулинов. Иммуносупрессоры используются после операций трансплантации, они могут уменьшать уровень иммуноглобулинов сыворотки.
Нарушения иммунитета с уменьшением кон-
центрации иммуноглобулинов в сыворотке могут возникнуть после массивных потерь белка, в частности при обширных ожогах, заболеваниях почек, эксфолиативном дерматите, белокте-ряющих энтеропатиях. Тяжелые травмы, серьезные оперативные вмешательства, массивные трансфузии, недоедание, угнетение иммунореак-тивной ткани токсикоинфекционным воздействием (длительные хронические инфекции, амило-идоз, острая атрофия печени), злокачественные поражения лимфоплазмацитарной системы (ми-елома, лимфолейкозы, миелолейкоз) также могут привести к иммунодефицитам.
Среди приобретенных иммунодефицитов особое место занимает СПИД (синдром приобретенного иммунодефицита), вызываемый ВИЧ (вирус иммунодефицита человека). При этом агам-маглобулинемия может возникнуть только у детей и схожа с некоторыми формами врожденного иммунодефицита. У взрослых при СПИДе, как правило, имеет место гипергаммаглобулинемия с различными нарушениями иммунной системы.
Гипергаммаглобулинемия
Гипергаммаглобулинемия возможна при повышенном синтезе антител как при острых, так и при хронических инфекционных заболеваниях. Нарастает содержание иммуноглобулинов всех классов, но преобладают IgG. Концентрация иммуноглобулинов увеличивается при всех бактериальных (стафилококковые, стрептококковые, пневмококковые) инфекциях, сепсисе, рожистом воспалении, скарлатине, ангине, пиодермии, инфекционном мононуклеозе, краснухе, хронических инфекциях (бруцеллез и др.), паразитарных заболеваниях (малярия, кала-азар, эхинококкоз печени, легких). Предпочтительное повышение уровня IgG имеет место при аутоим-муных заболеваниях; IgA - при инфекционных поражениях кожи, желудка, дыхательных путей, почек; IgM - при первичной вирусной инфекции и паразитарных инфекциях с накоплением паразита в крови (малярия).
Парапротеины (моноклональные иммуноглобулины)
Парапротеины (моноклональные иммуноглобулины) - это иммуноглобулины или их фрагменты, вырабатываемые плазматическими клетками, которые образуют из одной специфичес-
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
Проявление дефицита иммуноглобулинов
Таблица 71

| Заболеваемость | Обычно дети начинают болеть инфекционными заболеваниями в конце 1-го года жизни, когда исчезает материнский иммунитет |
| Патогены | Бактерии: pneumococci, Haemophilus influenzae, meningococci |
| Инфекционные болезни | Пневмонии, синуситы, отиты, менингиты, сепсис, понос, вирусный гепатит, энтеровирусный энцефалит |
| Типичные клинические признаки | Гипоплазия или атрезия лимфоидных органов (миндалин, лимфатических узлов) |
| Радиологическое исследование | Аденоидная гипоплазия |
| Типичный лабораторный признак | Снижение СОЭ, несмотря на инфекции |
Парапротеины при множественной миеломе
Таблица 72
| Белок | Частота встречаемости, % | Присутствие в моче белка Бенс-Джонса,% | Примечание |
| IgG | Пациенты устойчивы к иммунодефициту, парапротеинемия бывает очень высокой | ||
| igA | Тенденция к гиперкальциемии и амилоидозу | ||
| igD | Часты внекостные поражения, амилоидоз, почечная недостаточность, в половине случаев увеличены лимфоузлы, селезенка, печень. Плохой прогноз | ||
| igM | Часто увеличена вязкость крови | ||
| igE | 0,1 | В большинстве | - |
| Только белок Бенс-Джонса | Часто развиваются почечная недостаточность, амилоидоз, повреждения костей. Плохой прогноз |
 кой клетки линии В-лимфоцитов (моноклон). Парапротеины часто не способны выполнять функцию антител. Парапротеины обычно структурно однородны, т. е. молекула состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа или лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип не меняются в течение болезни. Так как все молекулы идентичны, то парапротеины определяются при электрофорезе белков по наличию узкого пика (М-градиента). Часто при электрофорезе выявляется более чем одна полоса парапротеинов, встречаются двойные М-градиенты и поликло-нальные гаммапатии. Миграция М-градиента может быть обусловлена присутствием фрагментов IgG или IgM, полимеризацией иммуноглобулинов или образованием комплексов иммуноглобулинов с другими белками плазмы.
кой клетки линии В-лимфоцитов (моноклон). Парапротеины часто не способны выполнять функцию антител. Парапротеины обычно структурно однородны, т. е. молекула состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа или лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип не меняются в течение болезни. Так как все молекулы идентичны, то парапротеины определяются при электрофорезе белков по наличию узкого пика (М-градиента). Часто при электрофорезе выявляется более чем одна полоса парапротеинов, встречаются двойные М-градиенты и поликло-нальные гаммапатии. Миграция М-градиента может быть обусловлена присутствием фрагментов IgG или IgM, полимеризацией иммуноглобулинов или образованием комплексов иммуноглобулинов с другими белками плазмы.
Парапротеины (обычно IgG или IgM) встречаются наиболее часто при множественной миеломе, при таких системных заболеваниях им-
Глава 13 / ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
мунной системы, как макроглобулинемия Валь-денстрема, острый плазмобластный лейкоз, болезни тяжелых цепей, лимфомы с парапротеи-немией и др.
Множественная миелома имеет место при диссеминированной злокачественной пролиферации клона В-лимфоцитов на уровне плазматических клеток. Множественная миелома составляет около 1% всех злокачественных новообразований, частота встречаемости миеломной болезни колеблется в разных этнических группах от 1 до 10 на 100 000 населения. Плазматические клетки наиболее часто пролиферируют диф-фузно по костному мозгу, но иногда формируют солитарную опухоль, называемую плазмоцито-мой. Из-за остеолитических повреждений развиваются тромбоцитопения, анемия и лейкопения. Одновременно подавляется формирование нормальных плазматических клеток, поэтому не образуются другие иммуноглобулины, развивается синдром возвратных инфекций.
При выявлении на электрофорезе сыворотки
24 |.1к.п>5.12
парапротеинов обязательным является электро-форетическое исследование мочи. Примерно в 20% случаев миеломной болезни опухоль продуцирует только легкие цепи иммуноглобулинов (табл. 72), которые из-за низкой молекулярной массы быстро фильтруются в почках и могут не обнаруживаться в сыворотке, но будут присутствовать в моче.
Для подтверждения диагноза в моче методом электрофореза определяют белок Бенс-Джонса, который располагается недалеко от старта соответственно М-градиенту в сыворотке, между у- и (3- глобулинами. Белком Бенс-Джонса названы легкие цепи иммуноглобулинов, присутствующие в моче (Бенс-Джонс первым описал эти белки), они накапливаются примерно в 75% всех случаев миеломной болезни.
Макроглобулинемия Вальденстрема - опухоль В-лимфоцитов, парапротеины при этом являются моноклональными IgM. Из-за накопления высокомолекулярных белков характерны повышение вязкости крови, нарушение микроциркуляции, сладж-синдром, предрасположенность к тромбозам, геморрагический синдром. Болеют преимущественно мужчины после 60 лет. Картина крови характеризуется анемией, в патогенезе которой играют роль опухолевое подавление эритропоэза, кровопотери, нередко наблюдается лейкопения с нейтропенией, моноцитоз, тромбоцитопения присоединяется по мере про-грессирования заболевания. СОЭ всегда резко увеличена, в сыворотке гиперпротеинемия, а на электрофореграмме - М-градиент за счет IgM. В моче белок Бенс-Джонса встречается примерно в 80% случаев, но количество его значительно меньше, чем при множественной миеломе. Лимфатические железы и селезенка увеличены, но лимфоидная инфильтрация прогрессирует, как правило, относительно медленно. Проявления болезни исчезают при заменной трансфузии.
Болезни тяжелых цепей представляют собой В-клеточные лимфатические опухоли с разнообразной клинической и морфологической картиной и секрецией фрагментов тяжелых цепей различных классов иммуноглобулинов. Это обычно
а-цепи, но могут также быть у- или ц-цепи. Выделяют две формы течения болезни: абдоминальную и легочную. Абдоминальная форма характеризуется диффузной инфильтрацией слизистой тонкой кишки и мезентериальных лимфатических узлов лимфоидными и плазматическими клетками, макрофагами, тучными клетками. Поражение желудочно-кишечного тракта приводит к атрофии ворсинчатого эпителия и развитию синдрома мальабсорбции. Легочная форма протекает с бронхопульмональными поражениями и медиастинальной лимфаденопатией. Про-теинурия отсутствует. Диагностика основана на иммунохимическом анализе сывороточных белков, позволяющем выявить тяжелые цепи иммуноглобулинов.
Криоглобулины
Криоглобулины - патологические белки плазмы (10-80 мг/мл), обладающие свойством превращения в желеобразное состояние при температуре ниже 37'С. Большинство криоглобулинов - это комплексы поликлональных иммуноглобулинов, в состав которых примерно наполовину входят моноклональные иммуноглобулины. Обычно это IgM. Криоглобулины могут появиться при макроглобулинемии Вальденстрема, миеломе, хроническом лимфолейкозе, инфекционных заболеваниях (мононуклеоз, сифилис, туберкулез, лепра), вирусных, аутоиммунных заболеваниях, циррозе печени, паразитозах, кол-лагенозах, при опухолевой трансформации клеток. С криоглобулином связаны синдромы холо-довой непереносимости, повышение вязкости крови, образование иммунных комплексов с факторами I, II, V, VII свертывания крови, что может сопровождаться кровоточивостью, активацией системы комплемента, вызывать поражение почек и гемолиз эритроцитов. Количество криоглобулинов определяют по отношению объема преципитированного глобулина к общему объему сыворотки.
Комплемент (см. разд. 3.2.2)
Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
 2015-03-22
2015-03-22 1491
1491