В термодинамике фаза определяется как равновесное состояние вещества, которое по своим физическим свойствам существенно отличается от других возможных равновесных состояний этого вещества. Переход вещества из одной фазы в другую называется фазовым переходом или фазовым превращением. К фазовым переходам первого рода относятся превращения, характеризуемые следующими основными свойствами:
а) поглощение или выделение скрытой теплоты перехода;
б) различие плотностей фаз;
в) скачкообразный характер появления новой фазы;
г) взаимное равновесие фаз в промежуточных состояниях фазового перехода;
д) существование метастабильных состояний типа перегретой жидкости или переохлаждённого пара.
Переход твердого вещества в жидкое (плавление) и обратный переход (кристаллизация) относятся к фазовым переходам первого рода, при которых скачком изменяются плотность, внутренняя энергия, энтропия тела. При этом поглощается (при плавлении) или выделяется (при кристаллизации) энергия, называемая теплотой плавления (кристаллизации).
|
|
|
 0 t,с |
При заданном давлении прямое и обратное фазовые превращения происходят при строго определенной температуре, поэтому изобарный фазовый переход одновременно является изотермическим. Одним из возможных способов измерения температуры и теплоты кристаллизации является метод построения диаграммы отвердевания(или плавления),т.е. кривой зависимости температуры отвердевающего (или расплавляемого) вещества от времени при неизменных внешних условиях.
Рис. 1
Для получения диаграммы, сосуд (ампулу) c исследуемым веществом помещают в печь и, нагревая его, измеряют через определенные промежутки времени температуру вещества в ампуле.
На диаграмме отвердевания (рис.1) качественно изображен процесс медленного охлаждения и кристаллизации металлической пробы (олово), помещенной в нагреваемую ампулу. При достаточно медленном охлаждении можно считать, что температуры Т пробы и ампулы одинаковы во всех точках. Эта температура отмечается по вертикальной оси диаграммы. Если тепловая мощность N, отдаваемая образцом, может считаться постоянной, то горизонтальная ось времени (рис.1) является одновременно и осью “теплоты, отданной образцом и ампулой”. Тепловая мощность N не равна мощности нагревателя, т.к. часть теплоты отводится в окружающую среду.
Левая и правая убывающие части кривой на рис.1 изображают остывание расплава и ампулы (слева) и остывание твердого образца и ампулы (справа). Тепловая мощность N на любом из этих участков равна изменению внутренней энергии системы за единицу времени:
|
|
|
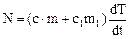 (1)
(1)
Массы пробы металла m и ампулы m1, а также их удельные теплоемкости с и c1 вблизи температуры плавления известны. Горизонтальный участок на рис.1 изображает процесс кристаллизации металла. Ордината его - температура плавления, а приращение абсциссы - время фазового перехода tф.п. Здесь выполняется равенство:
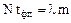 , (2)
, (2)
где l - удельная теплота кристаллизации. Исключив N из формул (1) и (2), найдем:
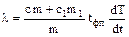 , (3)
, (3)
где 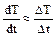 - скорость охлаждения образца.
- скорость охлаждения образца.
Любое изменение состояния системы в общем случае можно представить как результат бесконечно большого числа бесконечно малых изменений. Величина, равная отношению теплоты, полученной телом при изотермическом процессе, к температуре, при которой происходит теплопередача, т.е. Q/T, называется приведенной теплотой. Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса равно 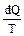 .Для обратимых процессов
.Для обратимых процессов 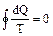 , следовательно,
, следовательно, 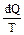 есть полный дифференциал некоторой функции, не зависящий от пути, каким система пришла в данное состояние.
есть полный дифференциал некоторой функции, не зависящий от пути, каким система пришла в данное состояние.
Функция состояния системы, характеризующая направление протекания самопроизвольных процессов в замкнутой термодинамической системе, называется энтропией, дифференциалом которой является выражение 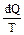 :
:
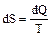 (4)
(4)
Если система перешла из состояния 1 в состояние 2, имеет смысл говорить только об увеличении или уменьшении энтропии системы, т.е. об её изменении:
DS =S2 - S1= 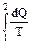
В замкнутых системах энтропия может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов):
DS ³ 0 (5)
Так как реальные процессы необратимы, то все процессы в замкнутой системе ведут к увеличению энтропии.
Также как и внутренняя энергия, энтропия обладает свойством аддитивности и является однозначной функцией состояния термодинамической системы.
Физический смысл энтропии был выяснен Больцманом, который связал энтропию с термодинамической вероятностью состояния системы W:
S =k lnW, (6)
где k - постоянная Больцмана.
Термодинамическая вероятность W состояния системы - это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние (по определению W³1).
Таким образом, энтропия определяется логарифмом статистического веса данной системы. Статистическим весом (или термодинамической вероятностью) системы называют число микроскопических (молекулярных) способов, с помощью которых может быть реализованно данное макросостояние этой системы. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Её статистическое толкование следующее: энтропия - мера молекулярного беспорядка в системе или мера неупорядоченности системы. Используя понятие энтропии, Больцман дал свою формулировку второго закона термодинамики: «Все процессы в природе протекают в направлении, приводящем к увеличению вероятности состояния».
При плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решетки. Подводимая при плавлении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. При подобных переходах - из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние - степень беспорядка увеличивается и, с точки зрения второго начала термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет и энтропия системы убывает.
При процессе кристаллизации выделяется количество теплоты:
DQ = l × m (7)
Тогда, используя формулу (4), имеем выражения для изменения энтропии DS в процессе кристаллизации:
|
|
|
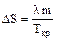 , (8)
, (8)
где Ткр - температура кристаллизации.
 2015-03-07
2015-03-07 905
905








