Полиэлектролитами называют высокомолекулярные соединения, макромолекулы которых содержат ионогенные группы, способные к диссоциации на ионы. В зависимости от природы и степени диссоциации ионогенных групп полиэлектролиты делятся на сильные и слабые поликислоты и полиоснования, а также на полиамфолиты. Полиэлектролиты последнего типа содержат основные и кислотные группы.

Полистиролсульфокислота - сильная поликислота
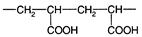
Полиакриловая кислота - слабая поликислота
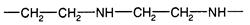
Полиэтиленимин - слабое полиоснование.
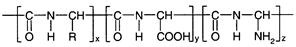
Белок – полиамфолит
Свойства заряженных макромолекул качественно отличаются в зависимости от суммарной величины заряда каждой макромолекулы: различают сильно заряженные полиэлектролиты, например ДНК, и слабо заряженные (слабые полиэлектролиты), например полиакриловая кислота. В сильно заряженных макромолекулах ионизирована большая часть звеньев, поэтому их свойства в основном определяются электростатическими (кулоновскими) взаимодействиями. В слабо заряженных макромолекулах ионизирована меньшая часть звеньев, их свойства определяются как электростатическими, так и неэлектростатиче
скими взаимодействиями, среди которых так называемое гидрофобное взаимодействие. Под этим термином подразумеваются силы притяжения между неполярными группами в полярной водной среде. Чередование микрообластей с полярными и неполярными взаимодействиями приводит к появлению регулярных неоднородностей в растворах полиэлектролитов.
Из теории двойного электрического слоя известно, что с уменьшением концентрации электролита диффузное облако противоионов, локализованное вблизи границы раздела заряженных фаз, «размывается» - в пределе по всему объему жидкой фазы. По аналогии можно считать, что с уменьшением концентрации растворов полиэлектролитов заряженные макромолекулы все в большей степени лишаются противоионов. Кроме того, в случае слабых полиэлектролитов константа диссоциации ионогенных групп увеличивается с разбавлением. В результате в разбавленных растворах полиэлектролитов электростатическое взаимодействие зарядов цепи достигает максимальной величины. Отталкивание зарядов одного знака приводит к максимально возможному распрямлению цепи, с ледовательно, в разбавленных растворах сильных электролитов среднеквадратичное расстояние между концами цепи равно
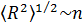 (1)
(1)
где п - число звеньев в цепи.
В случае слабо заряженных макромолекул расстояние между двумя соседними зарядами достаточно велико, поэтому энергия электростатического взаимодействия оказывается меньшей, чем энергия теплового движения звеньев, и недостаточной для распрямления цепи. Однако, и в этом случае электростатическое взаимодействие приводит к заметному изменению конформационного набора слабо заряженной цепи по сравнению с невозмущенной.
Наиболее ярко влияние зарядов проявляется при изучении вязкостных свойств полиэлектролитов. Рассмотрим зависимость вязкости раствора белка от рН среды (рис. 1). Минимальной вязкостью обладают растворы при рН, отвечающем изоэлектрической точке. В изоэлектрическом состоянии число диссоциированных кислотных и основных групп макромолекулы амфолита равно и минимально, вследствие чего суммарный заряд макромолекулы равен нулю. При этих условиях для цепи характерны свернутые конформации.
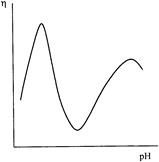
Рис.1. Вид зависимости вязкости раствора амфотерного полиэлектролита от рН среды
При изменении рН (по сравнению с рН изоэлектрической точки), вызванном добавкой низкомолекулярного электролита (кислоты или щелочи), степень диссоциации ионогенных групп полиамфолита увеличивается. Увеличение рН приводит к диссоциации кислотных групп (а), уменьшение рН вызывает диссоциацию основных групп (б):
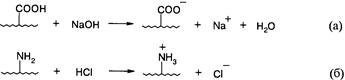
В обоих случаях цепь разворачивается в результате возникновения и отталкивания одноименных зарядов в ней. Это приводит к значительному возрастанию вязкости раствора. По достижении определенной степени диссоциации кислотных или основных групп, равной примерно 0,8, вязкость раствора при дальнейшем изменении рН начинает уменьшаться. Это происходит из-за уменьшения электростатического отталкивания зарядов цепи вследствие их экранирования противоионами добавляемого электролита.
Для определения изоэлектрической точки полиамфолитов можно использовать и другие свойства, связанные с зарядом частиц, например, набухание, осмотическое давление, рассеяние света. Кривые зависимости этих свойств от рН имеют минимум в изоэлектрической точке.
Взаимодействие полииона с низкомолекулярными противоионами приводит также к необычному виду зависимости приведенной вязкости раствора полиэлектролита от концентрации. Из рис. 2 видно, что с уменьшением концентрации раствора полиэлектролита его приведенная вязкость не уменьшается, как в случае растворов электронейтральных полимеров, а увеличивается.
Этот эффект объясняется тем, что разбавление раствора приводит к уменьшению степени экранирования заряда полииона. В результате электростатическое отталкивание зарядов цепи увеличивается, и она разворачивается. Описанный эффект получил название полиэлектролитного набухания. Он может быть устранен добавками электролита, ионы которого вызывают дополнительное экранирование зарядов полииона.
Благодаря взаимодействию полиионов с противоионами, поликислоты и полиоснования являются более слабыми полиэлектролитами по сравнению с низкомолекулярными аналогами. Так, в процессе титрования полиакриловой кислоты отрыв ионов водорода затрудняется из-за возрастающего притяжения их к полианиону. Поэтому поликислота ведет себя по мере дальнейшего ее титрования как все более слабый полиэлектролит.
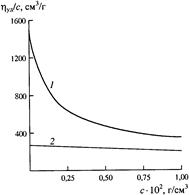
Рис. 2. Зависимость приведенной вязкости от концентрации раствора полиэлектролита: 1 - водный раствор поли-4-винил-N-бутилпиридиний-бромида, 2 - то же, с добавкой КВг
В случае полимерного основания, например поливинилпиридина, по мере протонирования основных групп положительно заряженная цепь все сильнее отталкивает ионы водорода, в результате ее основность уменьшается. Отсюда понятно, что измеряемая константа диссоциации полиэлектролита является усредненной, кажущейся величиной. От величины молекулярной массы полиэлектролита его кажущаяся константа диссоциации не зависит, за исключением области очень малых значений молекулярных масс.
Взаимодействие между противоположно заряженными полиэлектроли
тами в водной среде приводит к самопроизвольному образованию полиэлектролитных комплексов (ПЭК). В результате реакции могут образоваться два типа ПЭК: водонерастворисые (стехиометрические) и водонерастворимые (нестехиометрические). Последние получаются путем прямого смешения неэквимольных количеств полимерных компонентов при рН, где оба полиэлектролита заряжены. При этом степень связывания полиэлектролитов в комплекс не достигает величины, равной 1, что можно было бы ожидать при полном взаимодействии функциональных групп полимеров. Это свидетельствует о том, что структура нестехиометрического ПЭК содержит наряду с гидрофобными фрагментами (собственно комплекс) гидрофильные, за счет которых ПЭК удерживается в растворе.
Термодинамические свойства растворов полиэлектролитов заметно отличаются от термодинамических свойств растворов низкомолекулярных электролитов. Специфичным для растворов полиэлектролитов является так называемое равновесие Доннана или мембранное равновесие. Равновесие Доннана устанавливается в системах, имеющих границу раздела и содержащих ионы, способные и неспособные переходить через эту границу. К последним относятся полиионы и органические ионы большого размера. Равновесие Доннана с участием полиионов, например полианионов, может возникнуть в двух типах систем:
а) раствор полиэлектролита M+R- разделен с раствором низкомолекулярного электролита М+А- полупроницаемой перегородкой;
б) ограниченно набухший «сшитый» полиэлектролит M+R- (гель) находится в растворе низкомолекулярного электролита М+А-.
В обоих случаях систему можно представить следующей условной схемой (рис. 3.), где R- - полианионы, не способные переходить из области 1 в область 2; М+, А- - низкомолекулярные ионы, способные диффундировать через границу раздела областей 1 и 2.
По установлению равновесия электролит М+А- должен иметь одинаковую концентрацию по обе стороны границы раздела, т. е.
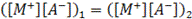 (1)
(1)
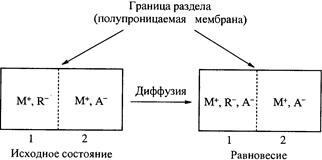
Рис. 3. К равновесию Доннана
Обозначим исходную молярную концентрацию ионогенных групп полиэлектролита с1, электролита с2 До установления равновесия часть низкомолекулярного электролита перейдет из области 2 в область 1, вследствие чего его концентрация в области 2 уменьшится на ∆с. На эту же величину возрастет концентрация иона М+ в области 1. После подстановки принятых значений концентраций в уравнение (2) получаем:
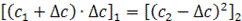 (2)
(2)
откуда:
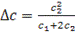 (3)
(3)
Анализ выражения (3) приводит к трем возможным результатам:
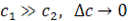
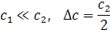
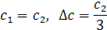
Таким образом, при концентрации полиэлектролита, соизмеримой с концентрацией низкомолекулярного электролита, последний распределяется по обе стороны полупроницаемой мембраны неравномерно. При более высокой концентрации полиэлектролита в занятую им область внешний электролит практически не проникает. Биологические клетки содержат относительно большое количество полиэлектролитов (до 10%) преимущественно амфотерного характера. Концентрация ионогенных групп полиэлектролитов внутри клетки на порядок выше концентрации ионов в среде, окружающей клетку. Поэтому «внешние» ионы проникают внутрь клетки в незначительной степени, благодаря чему ее солевой состав сохраняется практически неизменным.
Растворы полиэлектролитов еще более далеки от идеальных по сравнению с растворами электронейтральных полимеров. Это связано, в первую очередь, с наличием в них противоионов. Поэтому величины коллигативных свойств растворов (т. е. зависящих от числа частиц) определяются вкладом как полиионов, так и противоионов, причем вклад последних более существенен.
 2015-03-08
2015-03-08 2722
2722








