Поверхность молекулы фермента функционально неоднородна и взаимодействует с субстратом лишь определенным своим участком, который принято называть активный центр (АЦ). Активным центром фермента называется совокупность функциональных групп фермента, пространственно сближенных за счет вторичной и третичной структур и обеспечивающих захват, удержание и химическое преобразование субстрата. В однокомпонентных ферментах активный центр формируется за счет пространственного сближения функциональных групп радикалов аминокислот. В двухкомпонентных ферментах в состав активного центра включаются функциональные группы кофермента. В составе активного центра выделяют якорный участок, функция которого заключается в захвате и удержании субстрата, и каталитический, функция которого заключается в химическом преобразовании субстрата. Активный центр располагается, как правило, в углублении, нише поверхности фермента. В результате субстрат, соединяясь с активным центром, оказывается не в водном окружении цитозоля клетки, а в специфическом окружении активного центра.
Взаимодействие активного центра фермента и субстрата основано на комплементарности якорного участка субстрата.
В соответствии с теорией Фишера фермент и субстрат, обладая жесткой конформацией, взаимодействуют друг с другом благодаря абсолютному комплементарному соответствию активного центра фермента и субстрата (как ключ к замку см. рис.2.1.
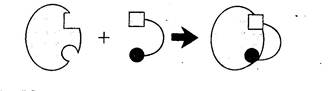
Рис.2.1 Взаимодействие фермента и субстрата в соответствии с моделью жесткой матрицы, предложенной Э. Фишером
Кошланд развил представления Фишера, выдвинув теорию индуцированного контакта, согласно которой активный центр фермента и субстрат имеют лишь общее стерическое соответствие. В момент взаимодействия происходит изменение конформации субстрата и активного центра фермента, что обеспечивает приведение в соответствие поверхностей якорного участка АЦ и субстрата (пример - одевание перчатки, см. рис.2.2).
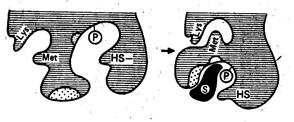
Рис.2.2. Конформационные изменения в молекуле фермента при связывании субстрата согласно модели индуцированного контакта Кошланда.
Образование фермент-субстратного комплекса подчиняется представлениям о трехточечной фиксации субстрата в якорном участке. При этом образуются ковалентные и в основном нековалентные связи. Благодаря трехточечной фиксации субстрат приобретает определенную ориентацию в активном центре фермента, создается максимальное пространственное сближение их функциональных групп.
 2015-03-08
2015-03-08 802
802








