Белками называют природные биополимеры, полученные за счет реакции поликонденсации α-аминокислот. Основной тип связи в белках – пептидная связь, образованная за счет межмолекулярной поликонденсации по основным функциональным группам. Различают ди-, три- и полипептиды. Полипептиды с молекулярной массой больше 10000 относят к белкам.
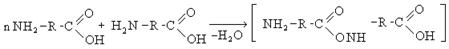
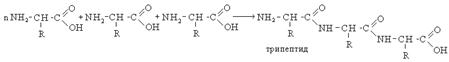
Структура белка рассматривается на трех уровнях.
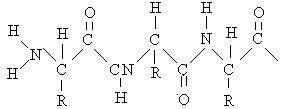
Первичная структура белка – это последовательность соединения аминокислотных звеньев в полипептидной цепочке. Основной тип связи – пептидная. Вторичная структура белка характеризуется закручиванием отдельных полипептидных цепей в спирали. Основной тип связи здесь – межмолекулярные сульфидные мостики (для аминокислот, содержащих серу) и солевые мостики.
Третичная структура белка формируется так же за счет межмолекулярных связей. В третичной структуре происходит комплектация отдельных спиралей в глобулы.
Все белки классифицируются по различным признакам.
По растворимости белки делят на фибриллярные и глобулярные. Фибриллярные белки составляют основу внешних покровных и мышечных тканей (волосы, рога, копыта, ногти, сухожилия). Структура фибриллярного белка представлена первичной структурой. Они нерастворимы в воде.
Глобулярные – это растворимые в воде белки. Глобулярными белками представлены гормоны, ферменты, кровь, лимфа.
По структуре белки делятся на простые (протеины) и сложные (протеиды). При гидролизе простых белков образуются только составляющие их аминокислоты. При гидролизе сложных белков образуются аминокислоты и небелковый компонент. В зависимости от небелкового компонента белки делятся на гликопротеиды, фосфопротеиды и нуклеопротеиды.
Протеины делятся на альбумины, проламины. Они различаются по растворимости в органических растворителях.
Процесс необратимого разрушения белка на всех уровнях зазывается денатурацией.
Функции белков в природе универсальны:
– каталитические (ферменты);
– регуляторные (гормоны);
– структурные (кератин шерсти, фиброин шелка, коллаген);
– двигательные (актин, миозин);
– транспортные (гемоглобин);
– запасные (казеин, яичный альбумин);
– защитные (иммуноглобулины) и т.д.
Контрольные вопросы
1. Рассмотрите строение триметиламина. В каком валентном состоянии находится атом азота в аминах? Какова пространственная конфигурация аминов? Какую орбиталь (s,p,sp) занимает в аминах неподеленная пара электронов?
2. Перечислите основные способы получения аминов.
3. Перечислите основные типы реакций, характерные для аминокислот. Рассмотрите их химические свойства как дифункциональных производных аминокислот.
4. Какие соединения называются ароматическими аминокислотами? Напишите структурные формулы фенилаланина и тирозина.
5. Объясните строение белков. Какие типы связей содержатся в белках?
6. Охарактеризуйте химические свойства белков. Цветные реакции на белки.
 2015-03-20
2015-03-20 969
969








