Азотистые вещества зерна ячменя имеют сложный химический состав. Они подразделяются на белковые вещества и аминокислоты. Белковые вещества подразделяются, в свою очередь, на простые и сложные белки.
Белковые вещества ячменя играют важную роль в технологических процессах пивоварения и влияют на качество готового продукта. Они являются питанием для дрожжей, участвуют в пенообразовании и формировании вкуса пива, влияют на стойкость пива при хранении.
Каждый белок характеризуется в зависимости:
- от числа и вида аминокислот, входящих в его состав;
- от последовательности расположения аминокислот в их соединении;
- от объемных структур, в которые упорядочены аминокислоты в молекуле протеина.
К аминокислотам, составляющим основу белков, относятся следующие: аланин, валин, лейцин, изолейцин, глицин, фенилаланин, аргинин, лизин, гистидин, аспарагиновая и глутаминовая кислоты, серин, треонин, тирозин, триптофан, цистенин, цистин, метионин, пролин, оксипролин.
Белки представляют собой длинные цепи остатков аминокислот, соединенных между собой пептидными связями (-СО-NН-), которые образуются в результате взаимодействия α- аминогруппы одной из аминокислот с α-карбоксильной группой другой с отщеплением воды.
На боковых цепях аминокислот находятся обычно важнейшие функциональные группы белков: сульфгидрильная (_SH); дисульфидная (_S—S-); аминная (-NН2); карбоксильная (-СООН); гидроксильная (-ОН) и т.д. Эти группы обусловливают реакционную способность белка и его отдельных участков. В ячмене белки, как правило, соединены с крахмалом, полисахаридами, полифенолами, ионами металлов и др.
Белки легко осаждаются минеральными кислотами: салициловой, пикриновой, фосфовольфрамовой и фосфомолибденовой, а также солями тяжелых металлов. С рядом соединений они дают характерные реакции: биуретовую, ксантопротеиновую и т. д. На этом основаны многие количественные и качественные методы определения белка.
Белки обладают способностью связывать значительные количества воды _ гидратироваться. Процесс гидратации состоит в связывании дипольных молекул воды с ионными группами в белках.
Форма белковой молекулы может быть весьма различной: от шарообразной до вытянутой. В первом случае _ это глобулярные белки, во втором фибриллярные. Глобулярные белки (основная группа белков) имеют молекулярную массу 104 - 105, размер 1,5 - 6,0 нм. Белки молекулярной массой 105 содержат 800 - 850 аминокислотных остатков, длина каждого остатка составляет приблизительно 0,35 нм. Пространственная конфигурация белков определяет их биологическую активность, лежит в основе ферментативных, гормональных и других свойств. Различают четыре уровня пространственной конфигурации белковой молекулы:
1) Первичная _соединение аминокислот в линейной цепи.
2) Вторичная _ пространственное расположение полипептидной цепи в виде ά-спирали, β-складчатого слоя.
3) Третичная _ специфическое укладывание ά-спирали в виде глобулы или фибрилл.
4) Четвертичная _ соединение нескольких частиц белка с третичной структурой в одну укрупненную.
Наличие всех видов структур у белков необязательно. Часто отсутствует четвертичная, либо может быть нарушена спиралевидная конфигурация цепей либо третичная структура.
Поддержание характерной пространственной макроструктуры частиц белка осуществляется за счет взаимодействий участков цепей и образования между ними поперечных связей: дисульфидных, гидрофобных, электростатических, водородных (рис. 5).
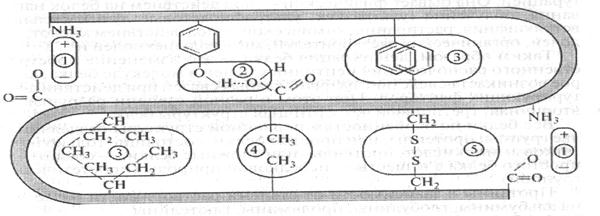
Рис.5 - Связи, стабилизирующие пространственную структуру белков: 1- ионная; 2- водородная; 3 и 4 – некоторые типы ван-дер-вальсовых взаимодействий; 5 – дисульфидный мостик (ковалентная связь)
Образование дисульфидных мостиков происходит следующим образом. В присутствии солей железа или других катализаторов тиоловая группа _SH цистеина в белках легко окисляется с образованием дисульфидной группы _S—S_. В молекуле белка два остатка цистеина могут образовывать ковалентную связь в виде дисульфидной связи. Дисульфидные связи нестабильны и легко подвергаются перегруппировкам.
Электростатические взаимодействия происходят между кислотными и основными группами аминокислот, входящих в структуру белка: концевыми, ε-аминогруппами лизина, гуанидиновыми группами аргинина, имидазольными группами гистидина.
Формирование структуры биологических макромолекул кроме водородных связей определяется гидрофобными связями. Именно от последних зависят те реальные формы, которые принимают макромолекулы белков. В отличие от водородных гидрофобные связи неполярные и возникают между боковыми группами белков, имеющих углеводородную природу, без участия воды. Молекулы воды как бы выталкиваются из той сферы, в которой возникает гидрофобное взаимодействие. К таким взаимодействиям способны остатки валина, лейцина, изолейцина, фенилаланина. Гидрофобные связи, как и водородные, имеют низкую величину энергии, но если их число достаточно велико, то они способны придать большой молекуле устойчивую структуру.При комнатной температуре другие молекулы не могут нарушить эту структуру, но по мере повышения температуры возрастающие силы молекулярных столкновений и энергия внутримолекулярных колебаний легко вызывают разрыв как водородных, так и гидрофобных связей.
Нарушение пространственной структуры белка называется денатурацией. Она бывает физической _ под действием на белок нагревания, облучения (ультразвук, ультрафиолетовые лучи), сильного встряхивания, растирания; химической _ под действием кислот, щелочей, органических растворителей, минеральных солей и т. д).
Таким образом, денатурация белка _ это изменение пространственного расположения пептидных цепей в молекуле белка, которое возникает вследствие разрыва слабых связей при действии денатурирующих факторов. При этом в разной степени разрушаются вторичная, третичная и четвертичная структуры белка.
Все белки по особенностям первичной структуры разделяют на две группы: протеины, или простые белки, состоящие только из остатков аминокислот; протеиды, или сложные белки, _ соединения простого белка с веществом небелковой природы (простетической группой).
Протеиды в зависимости от химической природы простетической группы разделяют на липопротеиды, гликопротеиды, хромопротеиды и нуклеопротеиды. В качестве простетической группы липопротеиды содержат жироподобные вещества — липоиды, гликопротеиды — углевод, хромопротеиды — пигменты, нуклеопротеиды — нуклеиновую кислоту.
Липопротеиды в большом количестве содержатся в протоплазме клеток. Типичный хромопротеид — гемоглобин. Гликопротеидами являются многие оксидоредуктазы. Нуклеопротеиды — особенно важная группа сложных белков, играющих громадную роль в жизнедеятельности организма. Они сосредоточены преимущественно в клеточных ядрах.
Образовавшиеся в ячмене белковые вещества откладываются преимущественно:
- в алейроновом слое в виде клейковины;
- на внешней стороне эндосперма в виде физиологического или резервного белка;
- в эндосперме в виде белка, идущего на построение тканей.
Клейковина алейронового слоя частично расходуется при проращивании, частично переходит в дробину.
Количество резервного белка непостоянно, что обусловливает различный белковый состав ячменей. При солодоращении большая часть резервного белка расщепляется.
Тканевой белок, как остаток протоплазмы, откладывается преимущественно в мембранах клеток эндосперма и вместе с гемицеллюлозой и гумми входит в состав этих клеток. Это в значительной степени затрудняет растворение. Весь запас тканевого белка переходит в дробину.
Простые белки – протеины составляют в ячмене основную часть азотистых веществ с высокой молекулярной массой. Обычно их классифицируют в зависимости от растворимости в различных растворителях на четыре большие группы: альбумины, глобулины, проламины и глютелины.
Альбумины (лейкозины) ячменя – высокомолекулярные нейтральные белки, которые содержат значительное количество серы (1,6 - 2,2%). Растворимы в воде и слабых солевых растворах. Они коагулируют из этих растворов при температуре около 52 0С. При кипячении сусла с хмелем полифенольные вещества хмеля ускоряют их коагуляцию. Лейкозин ячменя состоит из 16 компонентов. Область изоэлектрических точек альбуминов находится в интервале значений рН 4,6 - 5,8. Молекулярная масса в среднем 70000. Их содержание в ячмене составляет около 11% от общего содержания белка. Подвергаются ферментативному гидролизу; при кипячении полностью осаждаются.
Глобулины (эдестины) не растворяются в чистой воде, но растворяются в разбавленных растворах солей и, значит, до определенной степени растворяются в первом сусле. Их содержание составляет около 15% белка ячменя. Тепловая коагуляция глобулинов наблюдается при температуре свыше 900С. Изоэлектрическая точка фракций глобулина находится в пределах рН 4,9 - 5,7. Глобулин ячменя состоит из 4-х фракций:
a - глобулин с молекулярной массой 26 000;
b - глобулин – 100 000;
g- глобулин – 166 000;
d - глобулин – 300 000.
Причем различные фракции его локализуются в различных частях ячменя: γ – в зародыше, α- и β- в алейроновом слое. β-фракция самая большая среди глобулинов – 50 – 80%. Во время солодоращения количество β-фракции не изменяется, в то время как количество a- и g-глобулинов уменьшается, δ - фракции в солоде уже нет.
Количественное содержание фракций глобулина (в процентах от общего содержания глобулина) следующее: a - 3,5; b -3,5; g- 2,5; d - 1,5;
Особое внимание уделяется в пивоварении b-глобулину. Он более устойчив к нагреванию и труднее, чем альбумин, коагулирует из растворов. Он начинает коагулировать только при 90 0С. Кроме того, b-глобулин образует с полифенольными веществами соединения, вызывающие помутнения в пиве. Это очень реакционноспособный белок, что ускоряет его выпадение в осадок в готовом пиве. Кроме того, глобулин содержит серу, в виде сульфгидрильных групп – SH -, что также способствует выпадению в осадок этого белка в готовом пиве.
Проламины (гордеины) являются исключительно растительными белками и составляют около 37% ячменного белка. Они не растворяются в чистой воде и растворах солей, но растворяются в 50 - 90% этиловом спирте. При гидролизе сильными кислотами (серная и соляная) дают сравнительно большие количества глютаминовой кислоты и пролина. Молекулярная масса 27500.
Гордеин состоит из 5 различных компонентов (a, b, g, d, e), из которых d- и e-гордеин наиболее неблагоприятно воздействуют на коллоидную стойкость пива. Гордеину ячменя сопутствуют полифенолы – антоцианогены, соединенные с ним адсорбционными и химическими связями. С увеличением содержания белка в ячмене особенно возрастает количество гордеинов. Гордеин в основном остается в пивной дробине, однако отмечено присутствие этого белка в помутнении готового пива.
Ячменный глютелин (примерно 30% от общего содержания белка) не- растворим в воде, в разбавленных солевых растворах и спирте; растворяется в разбавленных растворах щелочей (0,2% растворах NаОН и КОН). Содержится в основном в алейроновом слое, гидролизу не подвергается, переходя в дробину неизменным. При гидролизе сильными кислотами глютелин образует большое количество глютаминовой кислоты и лейцина.
Содержание вышеперечисленных простых белков в ячмене составляет: альбумины – 0,4-0,5%, глобулины - 3%, проламины – 3-4%, глютелины – 3-4%, аминокислоты – 0,5-0,6%.
 2015-04-12
2015-04-12 2199
2199








