Клеточные циклы у эукариот качественно не различаются у разных видов и в клетках разных тканей одного вида. Замечены различия, главным образом, в длительности цикла. Среди высших эукариот некоторые клетки делятся через 10 минут, другие через 3 часа, третьи - через 200 часов.
Клеточный цикл у большинства соматических клеток высших эукариот подразделяют на 4 стадии: G1 (gap1, предсинтетический период, или период подготовки к синтезу ДНК), S (synthesis, период синтеза ДНК), G2 (gар 2, постсинтетический период подготовки к клеточному делению) и М (mitosis, собственно процесс клеточного деления). Иногда выделяют G0 - стадию между М и G1 или стадию покоя. В культуре клеток человека весь цикл занимает примерно 24 ч. при этом на стадии G1, S, G2 и М приходится 10, 9, 4 и 1 ч соответственно. Фазы G1, S и G2 вместе составляют интерфазу. Наиболее детальные сведения получены при изучении клеточных циклов дрожжей. Данные генетических и молекулярных исследований показали, что клеточные циклы включают ряд этапов, на которых осуществляется контроль продвижения клетки от одной фазы к другой - точки проверки или чекпойнты (checkpoints). Первая стадия проверки у дрожжей называется START, у млекопитающих — G1-checkpoint. Если клетка не выросла до необходимых размеров и окружающая среда недостаточно хороша; клетка будет оставаться в G1, т. е. не будет сигнала к синтезу ДНК (S-период).
В S-фазе разные участки генома реплицируются в разное время. В культуре клеток человека сначала синтезируется ДНК, которая выявляется в R-бэндах метафазных хромосом, обогащенных генами. В конце S-периода синтезируется ДНК G-бэндов. Полагают, что между этими отрезками S-периода также существует стадия проверки (проверка целостности ДНК, checkpoint DNA intregritу).
Стадия проверки G2 находится на границе G2 и М. Если не завершилась репликация всей ДНК, если клетка не выросла до нормальных размеров и окружающая среда недостаточно хороша, клетка не способна перейти к стадии М.
Третья проверка происходит в течение фазы М: хромосомы должны быть надежно прикреплены к нитям митотического веретена,
чтобы началось разделение хроматид. Схематически клеточный цикл показан на рис….
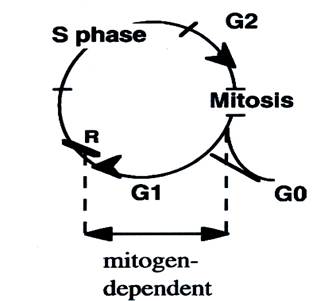
Рис…. Схема клеточного цикла эукариот.
Нарушения регуляции клеточного цикла и чекпойнт-контроля часто приводят к геномной нестабильности и предрасположенности к раку. Понимание молекулярных механизмов, которые регулируют эти процессы важно как для прикладной медицины, так и для фундаментальных научных исследований. Клеточный цикл проходит одинаково во всех эукариотических клетках, поэтому изучение его у различных организмов создает и наше общее понимание того, как различные события клеточного цикла контролируются и координируются у человека. Успешное деление зависит от того, насколько высоко скоординировано прошло удвоение и сегрегация клеточных компонентов. Координация завершается постановкой осуществления событий клеточного цикла под контроль высоко регулируемых протеинкиназ, известных как циклин-зависимые киназы.
Регуляция клеточного цикла у эукариот.
Различные клеточные процессы, необходимые для успешной репликации и деления клеток, управляются последовательной активаций и дезактивацией семейства циклин-зависимых киназ (Cdks). Активация преимущественно управляется периодической экспрессией циклинов и нуждается в активирующем фосфорилировании киназы. Инактивация контролируется во-первых, ингибирующим фосфорилированием киназ, во-вторых убиквитин-опосредованной деградацией циклинов и в-третьих -взаимодействием всего комплекса с малыми ингибирующими белками.
Основные принципы, положенные в основу регуляции прохождения клетки по циклу таковы:
1.Активация Cdks управляется последовательно экспрессией и объединением с циклинами.
2.Активность каждой пары Cdk-циклин необходима для активации последующей.
3.Разрушение циклинов приводит к однонаправленному клеточному циклу
4.Ингибирование комплексов Cdks-циклины путем фосфорилирования или путем связывания с белками-ингибиторами задерживает активацию Cdks и замедляет движение клетки по циклу в неблагоприятных условиях.
Как это следует из названия, Cdks являются протеин-киназами, которые для своей активации должны связаться с соответствующими циклинами. Процесс синтеза и деградации циклинов высоко координирован, в то время как основной уровень контроля Cdks заключается в периодичности присутствия или отсутствия циклиновой субъединицы. Данные об уровне экспрессии циклинов в течение клеточного цикла приведены на рис. ….
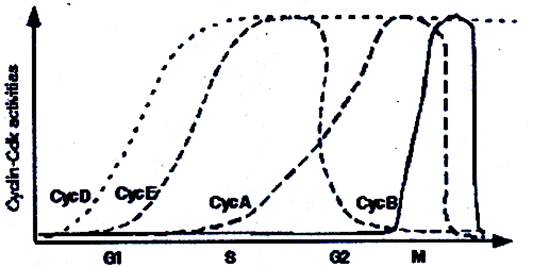
Рис….Экспрессия циклинов втечение клеточного цикла
Если покоящиеся клетки стимулировать к вхождению в клеточный цикл, то первым будет экспрессирован циклин D, который может объединяться с Cdk4 и Cdk6. Этот комплекс входит в ядро, где фосфорилирует белок ретинобластомы Rb и два других покет-белка р107 и р130. Фосфорилировани Rb приводит к высвобождению семейства транскрипционных факторов E2F и таким образом способствует экспрессии белков, необходимых для G1 и S-фаз клеточного цикла. Схема работы белка Rb показана на рис…..
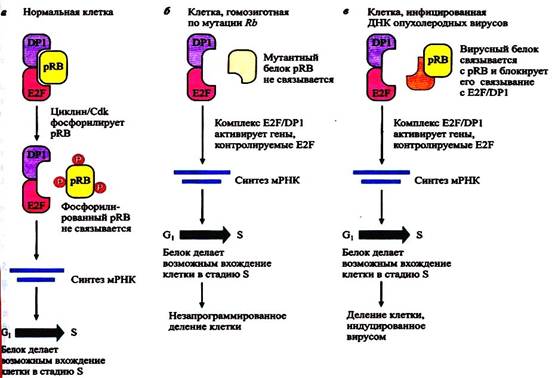
Рис…. Схема фосфорилирования белка Rb
Тот же митогенный сигнал, который вызвал экпрессию циклина D, также вызывает и экспрессию второго циклина – Е, и двух ингибиторов Cdks – р21cip1 и р27kip1. Экспрессия белков-ингибиторв в тот момент, когда клетка входит в новый цикл роста и деления кажется контрпродуктивной. Тем не менее, р21 и р27 связываются с коплексом циклин D- Cdk4 не ингибируя его киназную активность и на самом деле оказываются необходимыми для создания этого комплекса и его транспорта в ядро. Напротив, р21 и р27 являются эффективным ингибитором активности комплекса циклин Е- Cdk2. Таким образом, присутствие этих белков в ранней G1-фазе способствует образованию комплексов циклин D- Cdk4 и, в то же время, задерживает активацию циклин Е- Cdk2 комплексов.
Циклин Е- Cdk2 взаимодействует с циклин D- Cdk4/6 в фосфорилировании и инактивации Rb и покет- белков. Двойное фосфорилирование Rb необходимо для полной активации транскрипционной программы S-фазы. Таким образом ограниченное время движение клетки по циклу происходит независимо от внеклеточных сигналов. Внутренние или внешние события могут замедлить или предотвратить продвижение клетки по циклу, но если никакого останавливающего это движение сигнала получено не будет, то инициированный клеточный цикл, включая рост, репликацию, сегрегацию и деление будет продолжаться сам по себе без дальнейших внеклеточных посылов.
Активация циклин Е- Cdk2 ведет к инициации репликации ДНК, причем описано большое число белков, необходимых для осуществления задачи удвоения и сегрегации клеточного содержимого. Циклин Е- Cdk2 также фосфорилирует белок-ингибитор р27. Это делает р27 мишенью для распознавания убиквитин-лигазой, а убиквитинированная форма идет путем протеосомной деградации. Таким образом циклин Е- Cdk2 включает диструкцию своего отрицательного регулятора. Циклин Е- Cdk2 также автофосфорилируется по циклину Е, что тоже делает его мишенью для деградации. Это свойство подготавливать к деградации как ингибитор, так и сам циклин делает киназный комплекс одновременно самоактивирующим и самоограничивающим.
Циклин А экспрессируется сразу же после циклина Е на границе G1 и S фаз. Активность обоих комплексов - циклин Е- Cdk2 и циклин А- Cdk2 – для инициации и правильного протекания ДНК-репликации, а также для гарантии того, что репликация проходит в течение одного клеточного цикла только один раз. К тому же циклин А- Cdk2 способствует эффективному протеканию S-фазы, повышая транскрипцию гистоновых и других генов, необходимых для согласованной репликации.
После роста и удвоения клетки оказываются перед необходимостью делиться на две жизнеспособные дочерние клетки. Все завершается митозом, который начинается профазой с конденсацией хромосом и формированием веретена деления. В прометафазе микротрубочки веретена прикрепляются к кинетохорам двух сестринских хроматид, а оболочка ядра растворяется. Если все произошло правильно, то в анафазе веретено растаскивает сестринские хроматиды в разные стороны. Вслед за разделением удвоенного генома в телофазе деконденсируются хроматиды и начинают образовываться новые ядерные оболочки. Наконец, при цитокинезе разделением цитопоазмы завершается образование двух дочерних клеток. Эти драматические морфологические изменения происходят под контролем Cdk1 (Cdc2), ассоциированной с циклинами А и В. Экспрессия циклина В запаздывает по отношению к экспрессии циклина А, возрастая к поздней S-фазе и сохраняя высокий уровень в G2 и М. Так как комплекс циклин В- Cdk1 преимущественно пребывает в неактивной фосфорилированной форме, то постепенное возрастание количества циклина В не сопровождается таким же постепенным возрастанием киназной активности. Дефосфорилирование и активация циклин В- Cdk1 строго коррелирует с морфологическими изменениями, сопровождающими митоз. Ядерные ламины, белки ядрышек, центросомные белки и Eg5 (белок, связанный с движением кинезинов) являются субстратами циклин В- Cdk1 комплекса. Многокопийные органеллы, такие как митохондрии, распределены по цитоплазме равномерно, так, что дочерние клетки наследуют их вероятностно, случайным образом. С другой стороны, органеллы, существующие в единственном числе, такие как аппарат Гольджи, должны быть разделены активно. Cdk1 при ассоциации с другой субъединицей циклина В – В2, локализуясь преимущественно в зоне эндоплазматического ретикулума может играть ведущую роль при диспергировании аппарата Гольджи и гарантировать его разделение при цитокинезе таким образом, чтобы в обеих дочерних клетках оказались компоненты, достаточные для построения заново этого секреторного комплекса. Разные стадии митоза характеризуются очень быстрым и скоординированным исчезновением циклинов А и В. Разрушение митотических циклинов необходимо для того, чтобы гарантировать переход клеток в интерфазу до инициации следующего раунда ДНК-репликации. Это разрушение опосредуется anaphase promoting complex.
Белки-ингибиторы комплексов циклин-зависмых киназ с циклинами.
Важнейшим механизмом негативной регуляции комплексов циклин – Cdk является взаимодествие с малыми белками-ингибиторами. У млекопитающих описано два различных семейства ингибиторов Cdk - CKIs. Семейство Ink4 (р15, р16, р18 и р19), названные так по способности ингибировать Cdk4, связываются с мономерами Cdk4 и Cdk6. Все они представлены на рис….
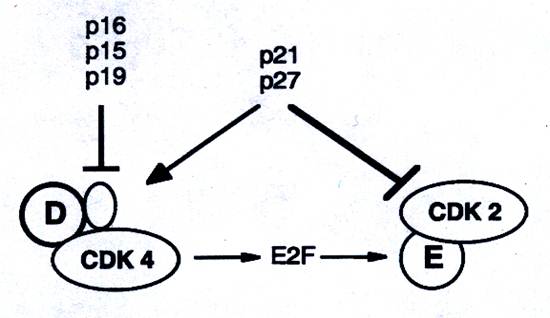
Рис… Ингибиторы комплексов циклин-CDKs
Ингибиторы связываются с ними в той же области, что и циклин D. Таким образом высокая экспрессия Ink4 блокирует образование активных комплексов циклин D –Cdk4. Так как Ink4 препятствуют образованию комплексов циклин D –Cdk4, то они увеличивают пул р27, способного связываться с комплексами циклин Е – Cdk2 и ингибировать их. Следовательно, ап-регуляция Ink4 напрямую ингибирует активность комплексов циклин D – Cdk4 и опосредованно - активность комплексов циклин Е –Cdk2. Второе семейство CKIs, Cip/Kip семейство (р21cip, p27kip и р57kip) ингибируют комплексы, содержащие Cdk2. Это семейство ингибиторов связывается с формирующимися комплексами, блокируя таким образом доступ к субстрату. Р21, первый из этих ингибиторов, является белком, экспрессия которого активируется р53 в ответ на повреждение ДНК.
Регуляция активности CDKS фосфорилированием.
Ассоциация киназы с циклином приводит к частичной активации киназного комплекса. Полная активация требует фосфорилирования по треонину внутри в районе Т-петли киназы. Киназы, способные к такому активирующему фосфорилированию называются Cdk-activating kinases (Cak). Активность самих Cak постоянна в течение клеточного цикла и, вероятно, небольшие ее модуляции влияют на движение по циклу.
Фосфорилирование Cdks также негативно регулирует их киназную активность. Активность Cdk1-циклин В является наиболее полно охарактеризованным примером ингибирующего фосфорилирования. Впрочем, активность циклин А –Cdk2, циклин Е – Cdk2 и циклин D – Cdk4 комплексов тоже регулируется этим способом. Ингибиторное фосфорилирование осуществляется рядом с N-концом с АТР-связывающим сайтом киназной субъеиницы, у человеческой Cdk1 это треонин-14 и тирозин-15. Фосфорилирование по тирозину-15 в основном осуществляется ядерной киназой Wee1, в то время как Myt1, цитоплазматический белок, связанный с мембранами цитоплазматического ретикулума и Гольджи, ведет фосфорилирование по треонину-14. Различная локализация этих киназ предполагает механизм, по которому Cdk1 может негативно регулироваться как в ядре, так и в цитоплазме. Ингибирующие фосфорилирование Cdks снимается семейством Cdc25 фосфатаз двойной специфичности. В клетках млекопитающих экспрессируются три формы Cdc25. Cdc25А действует в начале клеточного цикла, способствуя дефосфорилированию и активации циклин Е –Cdk2. Тогда как Cdc25В и Cdc25С обе принимают участие в переходе G2-M. Любопытно, что сами Cdc25 являются субстратами для Cdks: Cdc25А фосфорилируется и активируется циклин Е –Cdk2, а Cdc25С - циклин В –Cdk1. Это предполагает, что быстрая и полная активация Cdks стимулируется по принципу положительной обратной связи.
 2015-04-12
2015-04-12 3645
3645








